
【题目】

现欲用该浓硫酸配制成1mol/L的稀硫酸。现实验室仅需要这种稀硫酸220mL。试回答下列问题:
(1)用量筒量取该浓硫酸 mL;
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 ;
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 ;
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
(4)现需配制0.1mol/LNaOH溶液450mL。
①根据计算得知,所需NaOH的质量为 g;
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
【答案】(1)13.6
(2)250ml容量瓶,胶头滴管
(3)BCF
(4)①2.0 g ② BCAFED
【解析】试题分析:(1)现实验室需要这种稀硫酸220mL,需要用250 mL容量瓶,浓H2SO4的物质的量浓度c=![]() mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×1mol/L,解得:x≈13.6;(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是250ml容量瓶,胶头滴管;
mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×1mol/L,解得:x≈13.6;(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是250ml容量瓶,胶头滴管;
(3)A.用量筒量取浓硫酸时俯视,取用溶质偏少,所配溶液浓度偏小;
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中,溶液体积偏小,所配溶液浓度偏高;
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中,取用溶质偏大,所配溶液浓度偏高;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,溶液体积偏大,所配溶液浓度偏小;
E.容量瓶不干燥,无影响;
F.定容时,俯视容量瓶刻度线,,溶液体积偏小,所配溶液浓度偏高;
(4)现需配制0.1mol/LNaOH溶液450mL。需要用500 mL容量瓶,
①根据计算得知,所需NaOH的质量为![]() 2.0g;
2.0g;
②配制时,其正确的操作顺序是。
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
D.将容量瓶盖紧,振荡,摇匀


科目:高中化学 来源: 题型:
【题目】下列仪器不能用酒精灯直接加热的是
①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙
A. ③⑥⑦ B. ①⑤⑥ C. ①⑤ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Al与NaOH溶液反应的说法正确的是( )
A.Al是还原剂,NaOH及H2O均是氧化剂
B.还原产物是H2,且由H2O还原所得的H2与NaOH还原所得的H2物质的量之比为2∶1
C.此反应说明铝具有两性,铝的活泼性比只具有金属性的金属弱
D.此反应中,只有水是氧化剂,NaOH既不是氧化剂也不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下,反应2HBr(g) H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合气体的颜色加深,且使Br2的百分含量保持不变,可采取的方法是( )
A. 减小压强 B. 增大氢气浓度 C. 升高温度 D. 缩小体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠是一种重要的化工产品,利用氨碱法生产纯碱的流程如下图所示。

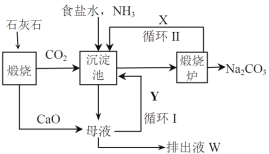
(1)沉淀池中发生反应的化学方程式为___________________;
(2)X是________,Y是_______(填化学式);
(3)排出液W中的溶质除了氢氧化钙外,还有_______、________;(至少两种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。

回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热会________(填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(4)丙组同学取10 ml 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com