
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。

已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
A.过滤 B.蒸发结晶 C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度。进行如下两个实验,实验过程中有关反应为:
i.
ii.ICl+KI=I2+KCl
iii.I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将0.500g该油脂样品溶于10mL四氯化碳后,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol•L—1的Na2S2O3,标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小”)。
③0.500g该油脂样品所消耗的ICl的物质的量为______mol。由此数据经换算即可求得该油脂的不饱和度。
(16分)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(3分)
MnCl2+Cl2↑+2H2O(3分)
(2)除去氯气中的氯化氢杂质(2分)
装置F中的水蒸气会进入装置D中,使ICl水解(或其他合理答案)(2分)
(3)C(2分)
(4)①淀粉溶液(2分)
②偏小(2分)
③5a(V2—V1)×10—4(3分)
【解析】
试题分析:(1)加热时二氧化锰能氧化浓盐酸,反应式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;(2)、装置A中逸出的气体主要成分是氯气、氯化氢和水蒸气,饱和食盐水能溶解氯化氢,不能溶解氯气,浓硫酸能吸水,故装置B的作用是除去氯气中的氯化氢杂质;若用F代替E,装置F中的水蒸气会进入装置D中,使ICl水解[或ICl(l)+Cl2(g)=2ICl3(l)],则所得产品不纯;(3)、由已知信息可知,ICl(l)和ICl3(l)均为液体,且互溶、沸点明显不同,由混合物分离、提纯的方法可知,从多的产品提纯的方法为蒸馏,而过滤适合分离固液不相溶的混合物,蒸发结晶适合互溶混合物中有一定溶解度的溶质,分液适合互不相溶的混合物;(4)、①由于淀粉溶液遇I2变蓝,则滴定过程中可用淀粉作指示剂;②滴定过程中需要不断振荡,使I2与Na2S2O3充分反应,使溶液褪色且半分钟内部恢复为蓝色,否则Na2S2O3溶液不足,V1偏小;实验1中n(Na2S2O3)=c•V=a•V1×10—3mol,由反应iii中反应物的系数之比等于物质的量之比,则n(I2)= n(Na2S2O3)/2=
5a•V1×10—4mol;由反应ii中反应物的系数之比等于物质的量之比,则n(ICl)=
n(I2)= 5a•V1×10—4mol;实验2中n(Na2S2O3)=c•V=a•V2×10—3mol,则n(I2)=
n(Na2S2O3)/2= 5a•V2×10—4mol,n(ICl)= n(I2)= 5a•V2×10—4mol;比较可知,实验1中被C=C键消耗的n(ICl)= 5a•V2×10—4mol—5a•V1×10—4mol=5a(V2—V1)×10—4mol。
MnCl2+Cl2↑+2H2O;(2)、装置A中逸出的气体主要成分是氯气、氯化氢和水蒸气,饱和食盐水能溶解氯化氢,不能溶解氯气,浓硫酸能吸水,故装置B的作用是除去氯气中的氯化氢杂质;若用F代替E,装置F中的水蒸气会进入装置D中,使ICl水解[或ICl(l)+Cl2(g)=2ICl3(l)],则所得产品不纯;(3)、由已知信息可知,ICl(l)和ICl3(l)均为液体,且互溶、沸点明显不同,由混合物分离、提纯的方法可知,从多的产品提纯的方法为蒸馏,而过滤适合分离固液不相溶的混合物,蒸发结晶适合互溶混合物中有一定溶解度的溶质,分液适合互不相溶的混合物;(4)、①由于淀粉溶液遇I2变蓝,则滴定过程中可用淀粉作指示剂;②滴定过程中需要不断振荡,使I2与Na2S2O3充分反应,使溶液褪色且半分钟内部恢复为蓝色,否则Na2S2O3溶液不足,V1偏小;实验1中n(Na2S2O3)=c•V=a•V1×10—3mol,由反应iii中反应物的系数之比等于物质的量之比,则n(I2)= n(Na2S2O3)/2=
5a•V1×10—4mol;由反应ii中反应物的系数之比等于物质的量之比,则n(ICl)=
n(I2)= 5a•V1×10—4mol;实验2中n(Na2S2O3)=c•V=a•V2×10—3mol,则n(I2)=
n(Na2S2O3)/2= 5a•V2×10—4mol,n(ICl)= n(I2)= 5a•V2×10—4mol;比较可知,实验1中被C=C键消耗的n(ICl)= 5a•V2×10—4mol—5a•V1×10—4mol=5a(V2—V1)×10—4mol。
考点:考查氯气的制法、混合物的分离和提纯、氧化还原反应滴定、信息迁移、物质的量在化学方程式计算中的应用等相关知识。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (写出一种即可)。
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式 。
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 =2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2+ NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为 。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是 。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷带解析) 题型:填空题
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。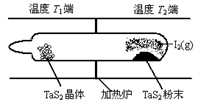
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 ,
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷解析版) 题型:填空题
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。

(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 ,
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中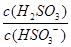 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com