
(1)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质有许多相似之处。已知锡元素具有如下性质: ;
;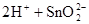



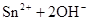 。
。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:_____________________________________________________,_______________________________________。
②将①中溶液蒸干后继续灼烧所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是__________(填化学式)。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱可选用________。
(2)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | 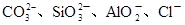 |
| 阳离子 |  |

(1)①Sn+2HCl =SnCl2+H2↑(1分); SnCl2+Cl2=SnCl4(1分)
②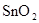 (1分) ③
(1分) ③ (1分)
(1分)
(3)①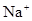 (1分)CO32-+2 H+=CO2↑+H2O
(1分)CO32-+2 H+=CO2↑+H2O 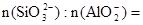 11:2
11:2
②Al(OH)3 +OH-- =AlO2-+2 H2O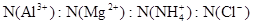 =2:1:4:12
=2:1:4:12
解析试题分析:(1)锡为第ⅣA族元素,化合价有+4和+2,有关反应类似于铁的相应变化,所以锡和盐酸反应:Sn+2HCl =SnCl2 + H2↑,再向反应后的溶液中通入氯气,SnCl2 + Cl2 =SnCl4;把SnCl4溶液蒸干再灼烧,类似于FeCl3溶液相应的变化,水解平衡向右移动,HCl挥发,剩余Fe(OH)3,不稳定受热分解生成Fe2O3,类比可知SnCl4溶液蒸干再灼烧,可得SnO2;Sn(OH)2既能按酸式电离,又能按碱式电离,是两性氢氧化物,所以可以溶于强酸强碱,因此选择弱碱制备,加氨水;(2)无色稀溶液,说明没有Cu2+,加入盐酸,能和AlO2-、SiO32-生成沉淀,ab段沉淀不再增加,是CO32-参与反应,bc段沉淀减少,是Al(OH)3溶解,有上述三种阴离子存在,则能存在的金属阳离子只有Na+,ab段发生反应的离子方程式为CO32- + 2 H+ = CO2↑+H2O,bc段消耗盐酸一格,假设一格为盐酸3摩尔,则可推断出Al(OH)3+3HCl=AlCl3+3H2O,根据铝守恒,可知AlO2-是1摩尔,oa段消耗盐酸四格,相当于盐酸12摩尔,AlO2-消耗盐酸1摩尔,剩余的11摩尔是SiO32-消耗,则可推知SiO32-为11/2摩尔,所以SiO32-和AlO2-的物质的量之比为11:2;②若Y是NaOH溶液,能和Mg2+、Al3+反应生成沉淀,ab段沉淀不再增加,是NH4+参与反应,bc段沉淀减少,是Al(OH)3溶解,bc段反应的离子方程式为Al(OH)3 + OH-- = AlO2- + 2 H2O,有上述三种阳离子存在,则能存在的阴离子只有Cl-,bc段消耗NaOH一格,假设一格为NaOH1摩尔,则可以推断Al3+1摩尔,oa段消耗NaOH四格,相当于NaOH4摩尔,Al3+消耗NaOH3摩尔,则可知Mg2+0.5摩尔,ab段二格,可知NH4+2摩尔,根据电荷守恒,可推知Cl-6摩尔,因此它们的离子个数比2:1:4:12
考点:考查金属及其化合物的性质、离子的共存、图像和计算


科目:高中化学 来源: 题型:单选题
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是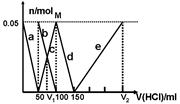
| A.M点时生成的CO2为0mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a曲线表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组微粒,在溶液中能大量共存的是
| A.K+、H+、NO3—、Cl— | B.Cu2+、Cl—、OH¯、SO42— |
| C.H+、Na+、HCO3—、Cl— | D.Ca2+、Cl—、K+、CO32— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组离子在溶液中能大量共存的是( )。
| A.Na+、Al3+、Cl-、SO42- | B.Cu2+、Cl-、NO3-、OH- |
| C.Ca2+、Na+、CO32-、NO3- | D.H+、SO42-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| C.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)> V(NaOH) |
| D.AgCl易转化为AgI沉淀且KSP(AgX)=c(Ag+)? c(X?),故KSP(AgI) > KSP(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.金属单质都能导电,非金属单质都不能导电 |
| B.离子化合物一定不含有共价键 |
| C.只含有共价键的物质一定是非电解质 |
| D.CaCl2在熔融状态下可导电,它是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
| A.无色透明的溶液:Na+、Al3+、Cl-、OH- |
| B.pH=1的溶液:Na+、NH4+、Cu2+、NO3- |
| C.与铝反应产生大量氢气的溶液:Na+、K+、Cl-、Al3+ |
| D.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列表示对应化学反应的离子方程式正确的是( )
A.NH4HCO3溶液与过量KOH浓溶液共热:NH4+ + OH-  NH3↑+ H2O NH3↑+ H2O |
| B.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: Ba2++ OH- + H+ + SO42- = BaSO4↓+ H2O |
| C.将少量醋酸溶液滴加到Na2CO3溶液中的反应:CH3COOH+CO32-= CH3COO-+HCO3- |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓+ CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00 mol·L-1NaOH溶液,有白色沉淀、无剌激气味气体。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
| A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ |
| B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ |
| C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1 |
| D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com