
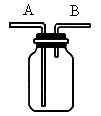
下图所示的装置有除杂、洗气、检验、贮气等用途.请回答:

(1)除去氢气、氧气混合气体中的水蒸气,装置内应盛的物质是________,气体应从装置的________(选填“A”或“B”)端捅入.
要除去氢气中混有的氯化氢气体,装置内应盛的物质是________.
(2)欲证明氧气中混有的氯化氢气体,装置内应盛________,反应中可观察到的现象是________.检验一氧化碳中混有的二氧化碳气体,装置内应盛________,观察到的现象是________.
(3)若用排空气法收集甲烷时,气体应从________,端通入;若用排水法收集一氧化碳时,瓶内先装满水,一氧化碳气体从________端通入;若用水将装置中的一氧化碳排出,进行实验时,水应从________端通入.
科目:高中化学 来源: 题型:022
下图所示的装置有除杂、洗气、检验、贮气等用途.请回答:
(1)除去氢气、氧气混合气体中的水蒸气,装置内应盛的物质是________,气体应从装置的________(选填“A”或“B”)端捅入.
要除去氢气中混有的氯化氢气体,装置内应盛的物质是________.
(2)欲证明氧气中混有的氯化氢气体,装置内应盛________,反应中可观察到的现象是________.检验一氧化碳中混有的二氧化碳气体,装置内应盛________,观察到的现象是________.
(3)若用排空气法收集甲烷时,气体应从________,端通入;若用排水法收集一氧化碳时,瓶内先装满水,一氧化碳气体从________端通入;若用水将装置中的一氧化碳排出,进行实验时,水应从________端通入.
查看答案和解析>>
科目:高中化学 来源: 题型:
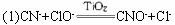
操作过程为:将浓缩后含CN-的污水(其中CN-浓度为0.05 mol·L-1)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡胶塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。试根据要求完成下列问题:
(1)甲中反应的离子方程式为:_______________________________________;乙中反应的离子方程式为:__________________________________________________。
(2)乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式:_______________________________________________________。
(3)丙中加入的除杂试剂是____________(填序号)。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
(4)丁在实验中的作用是______________________________________________。
(5)戊中盛有足量的石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率(填“>”“=”或“<”)____________80%。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省莆田市高三3月质量检测化学试卷(解析版) 题型:填空题
高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
[已知:FeO42-+3e-+4H2O Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如下图:
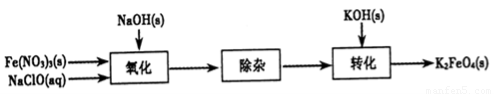
①完成氧化工序的离子方程式:
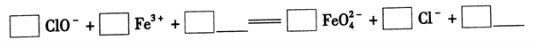
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有_____(写化学式)。
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4_____K2FeO4? (填“>”、“<”或“=”)。
(3)实验室模拟工业电解法制取K2FeO4,装置如右图。
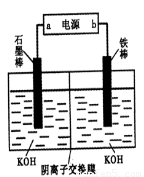
①此装置中电源的负极是____(填“a”或“b”)。
②阳极的电极反应式为______。
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
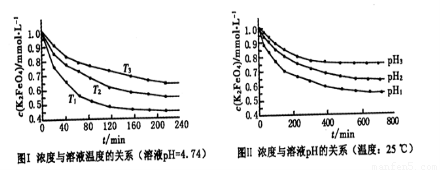
①由图I可得出的结论:该反应的△H___0(填“>”、“<”或“=”)。
②图Ⅱ中pH1___pH3(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com