

| A.X曲线是NaOH溶液滴定盐酸,Y曲线是NaOH溶液滴定醋酸 |
| B.当NaOH溶液体积为10mL时,把甲和乙溶液混合,则存在C(Cl-) =C(Na+)>C(CH3COOH)>C(H+)>C(CH3COO-) |
| C.当滴定到pH=7的甲、乙溶液中溶液中存在:C(Cl-)= C(CH3COO-) |
| D.当NaOH溶液体积为20mL时,甲、乙溶液存在C(Cl-)= C(CH3COOH) + C(CH3COO-) |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.0.01 mol/L盐酸 | B.0.01 mol/L Na2CO3溶液 |
| C.pH =" 4" NaHSO3溶液 | D.pH =11氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| n(SO3²﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
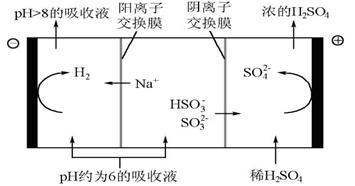
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C. H2SO4(aq)+ H2SO4(aq)+ Ba(OH)2(aq)=== Ba(OH)2(aq)=== BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=9 | B.c(OH-)≈10-5 mol·L-1 |
| C.pH≈7 | D.c(OH-)<10-7 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
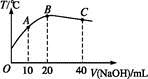
| A.醋酸的电离平衡常数:B点>A点 |
| B.由水电离出的c(OH-):B点>C点 |
| C.从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+) |
| D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com