
【题目】下列各组离子,在指定的环境中一定能大量共存的是( )
A.某无色酸性溶液中:NH![]() 、Ca2+、F-、Cl-
、Ca2+、F-、Cl-
B.与金属铝反应只放出氢气的溶液:K+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH![]() 、S2-、Br-
、S2-、Br-
D.滴加酚酞试液变红色的溶液:K+、Na+、S2-、Cl-
【答案】D
【解析】
A.无色溶液不含有色离子,酸性溶液中含有大量氢离子;
B.与Al反应生成氢气的溶液为弱氧化性酸或强碱溶液;
C.能和淀粉KI试纸变蓝色的溶液含有强氧化性微粒;
D.使酚酞试液变红色的溶液呈碱性,含有大量氢氧根离子,据此分析判断。
A.无色溶液不含有色离子,酸性溶液中含有大量氢离子,这几种离子都无色,但H+、F-反应生成弱电解质HF,不能大量共存,故A错误;
B.与Al反应生成氢气的溶液为弱氧化性酸或强碱溶液,酸性条件下NO![]() 和Al反应生成氮氧化物而不是氢气,碱性条件下NH
和Al反应生成氮氧化物而不是氢气,碱性条件下NH![]() 生成弱电解质,不能大量共存,故B错误;
生成弱电解质,不能大量共存,故B错误;
C.能使淀粉KI试纸变蓝色的溶液中含有强氧化性微粒,该强氧化性的微粒能氧化S2-,不能大量共存,故C错误;
D.使酚酞试液变红色的溶液呈碱性,这几种离子之间不反应且和氢氧根离子也不反应,能大量共存,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】某小组进行测定某变质的铁铝合金(杂质主要为Al2O3和Fe2O3)样品中铁含量,并制备Fe3O4胶体粒子,相关实验方案设计如下:

已知:乙醚[(C2H5)2O]易燃,沸点为34.5度,微溶于水,密度比水小。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答下列问题:
(1)溶液II中主要金属阳离子是__________________。
(2)步骤I中试剂A最佳选择的是_____________。
A.浓硝酸 B.浓硫酸 C.浓盐酸+双氧水 D.稀盐酸+双氧水
(3)步骤II的“一系列操作”包括如下实验步骤,选出其正确操作并按序列出字母:分液漏斗中加水检验是否漏水→向溶液中加入适量浓盐酸和乙醚,转移至分液漏抖→(__________)→(_________)→(__________)→(__________)→f→(_________)→a→(__________)→d→(_________)。
a.左手拇指和食指旋开旋塞放气;
b.用右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转,并用力振摇;
c.静置分层;
d.打开上口玻璃塞,将下层液体从下口放出,上层液体从上口倒出;
e.混合两次分液后的上层液体;
f.向下层液体中加入浓盐酸和乙醚并转移至分液漏斗;
(4)下列关于步骤Ⅲ和步骤VI的涉及的操作说法正确的是_______________。
A.步骤Ⅲ中蒸馏操作时,为加快蒸馏速度,采用酒精灯大火加热,收集34.5℃的馏分
B.为减少乙醚挥发,在蒸馏操作时,收集乙醚的锥形瓶应放置在冰水浴中
C.步骤VI由混合溶液制得Fe3O4胶体粒子的过程中,须持续通入N2,防止Fe2+被氧化
D.析出Fe3O4胶体粒子后通过抽滤,洗涤,干燥获得Fe3O4胶体粒子
(5)步骤IV测定Fe3+方法有多种,如转化为Fe2O3,间接碘量滴定,分光光度法等。
①步骤IV主要作用是测定样品中的铁总含量和______________________。
②步骤IV实验时采用间接碘量法测定Fe3+含量,具体过程如下:向25.00mL溶液中加入过量KI溶液,充分反应后,滴入几滴淀粉作指示剂,用0.1000mol·L-1Na2S2O3标准溶液进行滴定,到达滴定终点时,消耗Na2S2O3标准溶液体积为VmL。已知滴定反应为:I2+2Na2S2O3=2NaI+Na2S4O6。不考虑Fe3+和I-反应限度和滴定操作问题,实际测定的Fe含量往往偏高,其主要原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)。不能表示上述反应达到化学平衡状态的是( )
Si3N4(s)+12HCl(g)。不能表示上述反应达到化学平衡状态的是( )
A.单位时间消耗2molN2,同时生成6molH2
B.c(HCl)保持不变
C.混合气体密度保持不变
D.c(N2):c(H2):c(HCl)=1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式中,正确的是( )
A.醋酸的电离方程式:CH3COOH → CH3COO一+ H+
B.常温下NH4Cl溶液的pH < 7
C.因为SO3的水溶液能够导电,所以SO3是强电解质
D.在常温下的NaOH溶液中,由于NaOH抑制了水的电离,水的离子积常数(KW)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于电影《我不是药神》中对抗癌药物格列卫的关注,我国政府在2018年已经将格列卫等部分抗癌药物纳入医保用药,解决了人民群众用药负担。格列卫在其合成过程中的一种中间产物结构表示如下: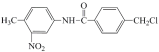 。下列有关该中间产物的说法不正确的是()
。下列有关该中间产物的说法不正确的是()
A. 该药物中间体属于芳香烃
B. 该药物中间体中含有三种官能团
C. 该药物中间体的所有碳原子可能共面
D. 该药物中间体可以发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物与人类生产、生活息息相关。
(1)FeCl3可用作止血剂。基态铁原子的核外电子排布式为______, Fe3+有______个未成对电子。
(2)K3[Fe(CN)6]主要应用于照相纸、颜料、制革、印刷等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
①K3[Fe(CN)6]中所涉及的元素的第一电离能由大到小的顺序_________。
②(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_________。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为________。
(3)CO能与金属Fe所形成的配合物Fe(CO)5,其熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示:

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_________。
A Fe(CO)5是非极性分子,CO是极性分子
B Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C 1mol Fe(CO)5含有10mol配位键
D 反应Fe(CO)5 = Fe+5CO没有新化学键生成
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示:
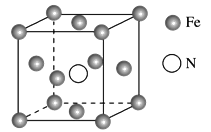
则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证AgI和 AgCl的 Ksp大小 | 向1mL 1mol·L-1NaCl溶液中滴加2滴 2mol·L-1 AgNO3溶液,生成白色沉淀;再滴加 2滴1mol·L-1KI溶液,白色沉淀变成黄色沉淀 | AgCl(s)+I-(aq) |
B | 比较HClO和 HF溶液的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO 溶液、0.1mol·L-1NaF 溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升髙显著增大 |
D | 检验某溶液中是否含有CO32- | 先滴加盐酸产生气泡,将该气体通入澄清石灰水中,有白色沉淀生成 | 该溶液中一定含有CO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]一定增大
B. 向0.1 mol·L-1的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
C. 向0.1 mol·L-1的NaHSO3溶液中加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-)
D. 可用浓度大于0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃[已知Ksp(BaSO4)=1.1×10-10]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com