


 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |
| D.FeS + 2H+= Fe2+ + H2S↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.溴酸银的溶解时放热过程 |
| B.温度升高时溴酸银溶解速度加快 |
| C.60 ℃时溴酸银的Ksp约等于6×10-4 |
| D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种难溶物中溶解度小的物质其KSP不一定小 |
| B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37
5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37| A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿 |
| B.由上述平衡可知,小孩长牙时要少吃糖多补钙 |
| C.若减小OH-的浓度,上述平衡将向右移动,Ksp的值相应增大 |
| D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
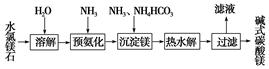
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.36×10-5 mol·L-1 |
| B.8.90×10-6 mol·L-1 |
| C.4.45×10-2 mol·L-1 |
| D.1×10-5 mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com