
����Ŀ���������д����ı�����Դ�������ǹ�ҵ�����ú�ˮ��ȡ���þ������ͼ��
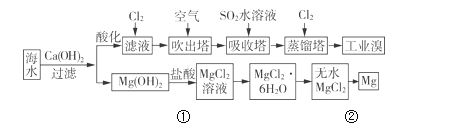
��1����ȡ��Ĺ����У��ڵ�2��Br����Br2 ��ת����ÿ����1mol�����ı��������______L��
��2�����������У��������Ͽ�����������Ҳ������Br2����________��
A��KBr B��Na2SO4 C��FeCl3 D��H2S
��3�����������з�����Ӧ�����ӷ���ʽ��_____________________��
��4��д��������þ�õ�þ���������漰���ķ�Ӧ����ʽ��_____________ ��____________��
���𰸡�22.4 D SO2+Br2+2H2O=4H++2Br-+SO42- Mg��OH��2+2HCl=MgCl2+2H2O MgCl2(����) ![]() Mg+Cl2��
Mg+Cl2��
��������
��1����ȡ��Ĺ����У��ڵ�2��Br����Br2 ��ת���з����ķ�Ӧ��2Br-+ Cl2= Br2+2 Cl����
��2�����������嵥�ʱ���ԭΪ�����ӣ�
��3�����������������������Ӧ��������������������Ӧ�����ӷ���ʽ��
��4���������������þ�����ᷴӦ�����Ȼ�þ��ˮ��������ǵ�������Ȼ�þ����þ��������
��1����ȡ��Ĺ����У��ڵ�2��Br����Br2 ��ת���з����ķ�Ӧ��2Br-+ Cl2= Br2+2 Cl�������ݷ���ʽ��ÿ����1mol������1mol��������״���µ������22.4L��
��2��A��KBr������Br2��Ӧ���ʲ�ѡA��
B��Na2SO4��ԭ�ԣ�������Br2��Ӧ���ʲ�ѡB��
C��FeCl3������Br2��Ӧ ���ʲ�ѡC��
D��H2S��Br2��Ӧ��������������ʣ���ѡD��
��3�����������������������Ӧ��������������ᣬ������Ӧ�����ӷ���ʽ��SO2+Br2+2H2O=4H++2Br-+SO42����
��4���������������þ�����ᷴӦ�����Ȼ�þ��ˮ����Ӧ����ʽ��Mg��OH��2+2HCl=MgCl2+2H2O��������ǵ�������Ȼ�þ����þ����������Ӧ����ʽ��MgCl2(����) ![]() Mg+Cl2����
Mg+Cl2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж���Դ�Ŀ�������������( )
A. ����������ͨ���糵�ȹ���ȡ����Դ��������һ����Դ
B. ����������һ�ֿ�������Դ,�й㷺��Ӧ��ǰ��
C. ̫���ܡ����ܡ����ܡ������ܶ���������Դ
D. ��ʯȼ�������������������,Ҫ���,��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SrSO4���������̻���մɹ�ҵ������Na2SO4��Һ�м���������Һ�������á���ͼ��ʾ��ͬ�¶��£�SrSO4��Һ��lg[c( Sr2+)]��lg[c( SO42��)]֮��Ĺ�ϵ�������й�˵����ȷ���� �� ��

A. ͼ����a ��c������ܶȻ�Ksp ( a ) < Ksp ( c )
B. 363KʱKsp (SrSO4) = 1.0��10��3.2
C. SrSO4���ܽ�����¶����߶�����
D. 313Kʱ��b���Ӧ����ҺΪ������Һ��d���Ӧ����ҺΪ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧ����������ίԱ����ȷ����116��Ԫ��Lv������Ϊ�W������![]() ����������� ( )
����������� ( )
A. ԭ������116B. ������177
C. ���������116D. ���ԭ������293
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������������������أ������й�˵���в���ȷ���ǣ� ��
A. ��ɫӫ�⵰���ʣ�GFP���Ǹ߷��ӻ�������ɽ��⣬��ˮ��Һ�ж����ЧӦ
B. ����ͷı������˻��������������ɫ��Ӧ��ԭ��
C. �����谷���ӽṹ��ͼ��ʾ ������ʽ��C3H6N6
������ʽ��C3H6N6
D. �����衢���ά���������մɵ������������ǽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������H2O2�����Ļ��ϼ�Ϊ��1�ۣ�������˫��ˮ��ҽ������������ɱ��������������ϴ�˿ڡ���������A��D�漰H2O2�ķ�Ӧ����д�հף�
A��Na2O2+2HCl===2NaCl+H2O2
B��Ag2O+H2O2===2Ag+O2��+H2O
C��2H2O2===2H2O+O2 ��
D��3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
��1��H2O2�����������Եķ�Ӧ��_________������ţ���H2O2�����������������ֻ�ԭ�Եķ�Ӧ��_________������ţ���
��2����ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ��
������Ӧ��H2O2��2e��===2H++O2��
��ԭ��Ӧ��MnO4��+5e��+8H+===Mn2++4H2O
д����������ԭ��Ӧ�����ӷ���ʽ��___________________��
��3������ʵ�����õ�һ�����ʵ���Ũ�ȵ�ϡ���ᣬ������1mol/L��ϡ������Һ480mL������18mol/LŨH2SO4____mL����������Ҫ�õ�����Ҫ���������ǣ�����ţ�______��A��100mL��Ͳ B��������ƽ C�������� D��100mL����ƿ E��50mL ��Ͳ F����ͷ�ι� G���ձ� H��500mL����ƿ
��4����������������ϡ������ҺŨ��ƫ�ߵ���______________
A���ܽ����Һû����ȴ�����¾�ת��
B��ת��ʱû��ϴ���ձ���������
C��������ƿ��ˮ����ʱ�۾�����Һ��
D������Ͳ��ȡŨ�����ϴ����Ͳ����ϴ��Һת�Ƶ�����ƿ
E��ҡ�Ⱥ���Һ����ڿ̶��ߣ��ּ�����ˮ���̶���
��5����ͼ��һ���õ��ԭ�����Ʊ�H2O2�����ò�����H2O2�����ϰ�ˮ��װ�á�
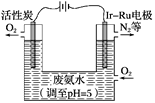
��Ϊ�˲�Ӱ��H2O2�IJ�������Ҫ��ϰ�ˮ�м�������HNO3������Һ��pHԼΪ5����������Һ��c(NH4��)________(����>����������������)c(NO3��)��
��Ir��Ru���Ե缫����O2����H2O2����缫��ӦʽΪ��______________________��
�������ϵ�·��ÿת��3 mol e���������Դ����ϰ�ˮ������(��NH3��)��������________g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com