
【题目】有机物M只含C、H、O三种元素。取13.6g M在足量氧气中燃烧,生成35.2g CO2和7.2g H2O。在相同条件下,M的蒸气对氢气的相对密度为68。
(1)通过计算确定M的分子式。(要求:写出解题过程)____________。
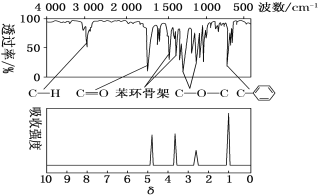
(2)经测定:M的红外光谱和核磁共振氢谱分别如下图所示,则M的结构简式为_______。
【答案】C8H8O2 ![]()
【解析】
(1)依据有关有机物分子式确定的计算方法计算;
(2)由M的红外光谱和核磁共振氢谱确定M的结构简式。
(1)由M的蒸气对氢气的相对密度为68可知M的相对分子质量为:2×68=136,13.6g M的物质的量为n(M)=![]() =0.1mol,由原子个数守恒可知,n(C)=n(CO2)=
=0.1mol,由原子个数守恒可知,n(C)=n(CO2)=![]() =0.8mol,n(H)=2n(H2O)=2×
=0.8mol,n(H)=2n(H2O)=2×![]() =0.8mol,则n(O)=
=0.8mol,则n(O)=![]() =0.2mol,由n(M):n(C):n(H):n(O)=0.1mol:0.8mol:0.8mol:0.2mol=1:8:8:2,即1mol M含有C、H、O的物质的量分别为8mol、8 mol和2mol,M的分子式为C8H8O2,故答案为:C8H8O2;
=0.2mol,由n(M):n(C):n(H):n(O)=0.1mol:0.8mol:0.8mol:0.2mol=1:8:8:2,即1mol M含有C、H、O的物质的量分别为8mol、8 mol和2mol,M的分子式为C8H8O2,故答案为:C8H8O2;
(2)由M的红外光谱可知,M分子中含有苯环、甲基和酯基,由核磁共振氢谱可知M分子中有4类氢原子,则M的结构简式为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A.将pH试纸放在实验台上测量溶液的pH
B.通过蒸干FeCl3溶液制取无水FeCl3固体
C.可用热的烧碱溶液区分植物油和矿物油
D.将8 g NaOH固体置于100 mL容量瓶中,加水至刻度线,配制2 mol·L-1 NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别在三个容积均为2.0L的恒容密闭容器中发生反应:A(g)+B(g)D(g)。其中容器甲中反应进行至5min时达到平衡状态,相关实验数据如表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | 化学平衡常数 | ||
n(A) | n(B) | n(D) | n(D) | |||
甲 | 500 | 4.0 | 4.0 | 0 | 3.2 | K1 |
乙 | 500 | 4.0 | a | 0 | 2.0 | K2 |
丙 | 600 | 2.0 | 2.0 | 2.0 | 2.8 | K3 |
下列说法不正确的是
A.0~5min内,甲容器中A的平均反应速率v(A)=0.64mol·L-1·min-1
B.a=2.2
C.若容器甲中起始投料为2.0molA、2.0molB,反应达到平衡时,A的转化率小于80%
D.K1=K2>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用含淀粉质量分数为76%的陈化粮10.0t来制取乙醇。如果在发酵过程中有81%的淀粉转化为乙醇,制得的乙醇溶液中含乙醇质量分数为40%,则可制得这样的乙醇溶液质量是
A. 8.74 tB. 9.45tC. 9.88tD. 10.25t
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室制备少量1-溴丙烷的主要步骤如下:
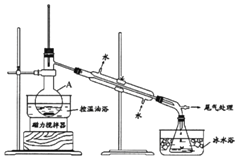
步骤1:在仪器A中加入搅拌磁子、12g 1-丙醇及20mL水,在冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr。
步骤2:缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分离出有机相。
步骤4:将分离出的有机相转入分液漏斗,依次用H2O、5%的Na2CO3溶液洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
已知:①1-溴丙烷沸点为71℃,密度为1.36g/cm3;
②反应过程中,在仪器A中可以观察到A的上方出现红棕色蒸气(Br2)。
回答下列问题:
(1)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(2)仪器A中主要发生反应为:NaBr + H2SO4===HBr + NaHSO4和______。
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是______,同时可以观察到的现象是______。
(4)步骤4中的两次洗涤,依次洗去的主要杂质是______、_________。
(5)步骤4中的Na2CO3溶液还可以用下列中的______试剂代替。
A.NaOH溶液 B.NaI溶液 C.Na2SO3溶液 D.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液里lgX [X表示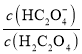 或
或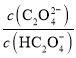 ]随pH的变化关系如图所示。下列说法不正确的是( )
]随pH的变化关系如图所示。下列说法不正确的是( )
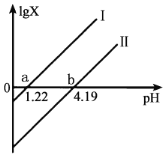
A.由图可知H2C2O4的K2的数量级是10-5
B.b点为恰好完全反应点
C.c(HC2O4-)>c(C2O42-)>c(H2C2O4)对应1.22<pH<4.19
D.c(Na+)= c(HC2O4-)+2c(C2O42-)对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。以含钴废料(主要成分为Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下图所示:

已知:
Ⅰ.“酸浸”后的浸出液中含的阳离子有H+、Co2+、Fe3+、Ni2+等。
Ⅱ.部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 |
完全沉淀时的pH | 3.7 | 9.0 | 9.2 |
回答下列问题:
(1)“酸浸”含钴废料的温度不宜过高,原因是_____________。
(2) “酸浸”时发生的主要反应是___________________(写离子方程式)。
(3)某萃取剂对金属离子的萃取率与溶液pH的关系如图所示:
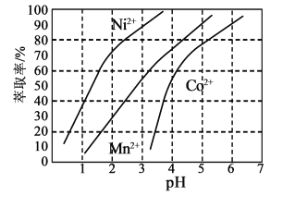
使用该萃取剂时应控制的pH约为____________,理由是_____________。
(4)写出高温煅烧时发生的化学反应方程式___________。
(5)操作1得到的副产品是__________(填名称);
已知该物质的溶液加热到100℃时会变质,该物质的溶解度见下表:
湿度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
溶解度 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 88.0 |
操作1是________(填字母)。
a.蒸发结晶 b.降温结晶 c.减压蒸发结晶
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)晶体的自范性即__________,区分晶体与非晶体最可靠的实验方法是________;
(2)原子间通过共用电子对所形成的相互作用叫做共价键。δ键与π键都属于共价键,δ键的特征是__________,Π键的特征是__________。
(3)Li2O是离子晶体,其晶格能可通过下图的BomHaber循环计算得到。
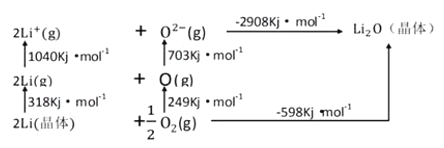
可知,Li原子的第一电离能为__________kJ/mol,O=O键键能为______kJ/mol,Li2O的晶格能为_________ kJ/mol。
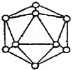
(4)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由_______个硼原子组成,共含有__________个BB键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。完成下列填空:
(1)写出该共聚物的结构简式________。
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体![]() 。写出该两步反应所需的试剂及条件_______、__________。
。写出该两步反应所需的试剂及条件_______、__________。
(3)将![]() 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。A的结构简式为_______。由上述反应可推知_________。由A生成对溴苯乙烯的反应条件为______。
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。A的结构简式为_______。由上述反应可推知_________。由A生成对溴苯乙烯的反应条件为______。
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面,写出B的结构简式_______。设计一条由2,3-二甲基-1-丁烯制备B的合成路线_______。(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com