
【题目】(1)晶体的自范性即__________,区分晶体与非晶体最可靠的实验方法是________;
(2)原子间通过共用电子对所形成的相互作用叫做共价键。δ键与π键都属于共价键,δ键的特征是__________,Π键的特征是__________。
(3)Li2O是离子晶体,其晶格能可通过下图的BomHaber循环计算得到。
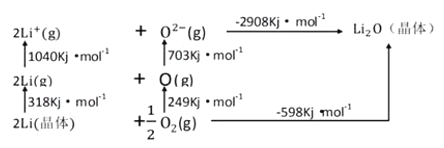
可知,Li原子的第一电离能为__________kJ/mol,O=O键键能为______kJ/mol,Li2O的晶格能为_________ kJ/mol。
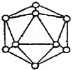
(4)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由_______个硼原子组成,共含有__________个BB键。
【答案】能自发地呈现多面体外形的性质 X射线衍射 轴对称 镜面对称 520 498 2908 12 30
【解析】
(1)晶体的自范性是指:在适宜的条件下,晶体能够自发地呈现封闭的规则和凸面体外形的性质,晶体的自范性是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象;X-射线衍射法是区分晶体和非晶体的最科学的方法;
(2)δ键是电子云头碰头重合,Π键是电子云肩并肩重合;
(3)根据第一电离能的定义,结合图示能量变化分析;结合图示能量变化判断化学键的键能和晶格能大小;
(4)根据晶体硼的晶胞结构判断。
(1)晶体的自范性是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象;区分晶体和非晶体的最科学的方法是X射线衍射;
(2)原子间通过共用电子对所形成的相互作用叫做共价键。共价单键都是δ键,而共价双键一个是δ键,,一个是π键,δ键是电子云头碰头重合,δ键的特征是轴对称,可以沿轴的方向旋转,π键是电子云肩并肩重合,重叠程度小,π键的特征是镜面对称,不能旋转,一旦旋转,共价键就被破坏;
(3)第一电离能是气态基态原子失去一个电子,形成带一个单位负电荷的气态基态阳离子所需吸收的最低能量,由图可知Li的第一电离能为1040kJ/mol÷2=520kJ/mol;
由于![]() O2(g)变为O(g)吸收能量为249kJ/mol,所以O=O键的键能为2×249kJ/mol=498 kJ/mol;
O2(g)变为O(g)吸收能量为249kJ/mol,所以O=O键的键能为2×249kJ/mol=498 kJ/mol;
由于2mol气态基态Li+与1mol气态基态O2-结合形成Li2O晶体释放能量是2908kJ,所以Li2O的晶格能为-2908 kJ/mol;
(4)硼原子组成的正二十面体,即每个面就是一个等边三角形,共有20个面,每个顶点为5个三角形所共用,所以20个等边三角形所含有的顶角数=20×3÷5=12,即原子个数为12;因为每条边为2个三角形所共用,所以20个等边三角形含有的边数=20×3÷2=30,即B-B键数为30。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. B的物质的量浓度 B. 混合气体的密度
C. 混合气体的压强 D. v(B消耗)=3v(D消耗)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M只含C、H、O三种元素。取13.6g M在足量氧气中燃烧,生成35.2g CO2和7.2g H2O。在相同条件下,M的蒸气对氢气的相对密度为68。
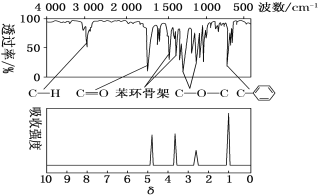
(1)通过计算确定M的分子式。(要求:写出解题过程)____________。
(2)经测定:M的红外光谱和核磁共振氢谱分别如下图所示,则M的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 60g丙醇中存在的共价键总数为10NA
B. 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA
D. 235g核互U![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() n
n![]()
![]() +
+![]() +10
+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是( )

A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+
B.过程②中,Fe3+作氧化剂
C.转化图中化合价不变的元素只有铜和氯
D.回收S的总反应为2H2S+O2=2H2O+2S↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
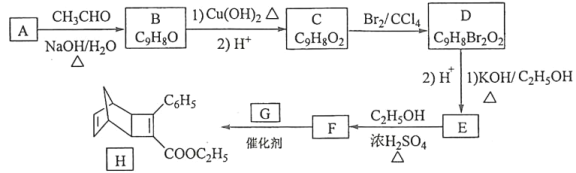
已知:
回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
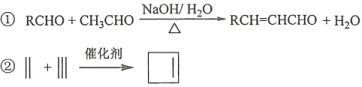
(6)写出用环戊烷和2–丁炔为原料制备化合物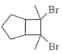 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
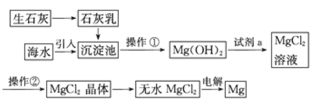
提示:①MgCl2晶体的化学式为MgCl2·6H2O。
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是______,操作②的名称______、_____、过滤。
(2)试剂a的名称是_____。
(3)用氯化镁电解生产金属镁的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2为原料可制取电极材料锰酸锂(LiMnxOy),工业上利用菱锰矿粉(MnCO3)制备MnO2的流程如图:
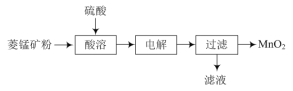
(1)“酸溶”过程中加入过量的硫酸目的是___。
(2)写出“电解”反应的离子反应方程式:___。
(3)为测定LiMnxOy中Mn元素的平均化合价(高于+2价),现进行如下实验:
步骤1:取少量LiMnxOy,分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.400mol·L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol·L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液16.00mL。
步骤3实验过程中物质发生的转化如下,其中C2O42-均转化为CO2:
LiMnxOy![]() Mn2+;MnO
Mn2+;MnO![]()
![]() Mn2+
Mn2+
①步骤3滴定终点时的实验现象是___。
②计算LiMnxOy中Mn元素的平均化合价___(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com