
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是( )

A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+
B.过程②中,Fe3+作氧化剂
C.转化图中化合价不变的元素只有铜和氯
D.回收S的总反应为2H2S+O2=2H2O+2S↓
【答案】C
【解析】
由图可知:一共发生的有三个反应①H2S+Cu2+=CuS↓+2H+;②CuS+2Fe3+=2Fe2++Cu2++S;③4Fe2++4H++O2=4Fe3++2H2O,由此可以推出总反应 2H2S+O2=2S↓+2H2O,再结合氧化还原反应中的基本概念解题。
A.根据图中转化可知,生成CuS的反应为H2S + Cu2+=CuS↓+ 2H+,A正确;
B.过程②中,Fe3+转化为Fe2+,Fe3+为氧化剂,B正确;
C.结合分析中的三个方程式,转化过程中化合价不变的元素除了有铜、氯之外还有氢,C错误;
D.根据图中转化可知,反应物为H2S和O2,生成物为S,根据原子守恒,还有水生成,总反应是2H2S+O2=2H2O+2S↓,D正确;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,3.2gO2中氧分子数为0.1NA
B.标准状况下,22.4L正己烷中碳原子数为6NA
C.78gNa2O2在足量CO2中充分反应转移的电子数约为2NA
D.密闭容器中,3molH2和1molN2充分反应后氨分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室制备少量1-溴丙烷的主要步骤如下:
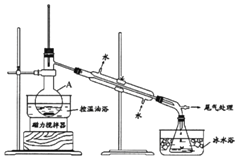
步骤1:在仪器A中加入搅拌磁子、12g 1-丙醇及20mL水,在冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr。
步骤2:缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分离出有机相。
步骤4:将分离出的有机相转入分液漏斗,依次用H2O、5%的Na2CO3溶液洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
已知:①1-溴丙烷沸点为71℃,密度为1.36g/cm3;
②反应过程中,在仪器A中可以观察到A的上方出现红棕色蒸气(Br2)。
回答下列问题:
(1)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(2)仪器A中主要发生反应为:NaBr + H2SO4===HBr + NaHSO4和______。
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是______,同时可以观察到的现象是______。
(4)步骤4中的两次洗涤,依次洗去的主要杂质是______、_________。
(5)步骤4中的Na2CO3溶液还可以用下列中的______试剂代替。
A.NaOH溶液 B.NaI溶液 C.Na2SO3溶液 D.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。以含钴废料(主要成分为Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下图所示:

已知:
Ⅰ.“酸浸”后的浸出液中含的阳离子有H+、Co2+、Fe3+、Ni2+等。
Ⅱ.部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 |
完全沉淀时的pH | 3.7 | 9.0 | 9.2 |
回答下列问题:
(1)“酸浸”含钴废料的温度不宜过高,原因是_____________。
(2) “酸浸”时发生的主要反应是___________________(写离子方程式)。
(3)某萃取剂对金属离子的萃取率与溶液pH的关系如图所示:
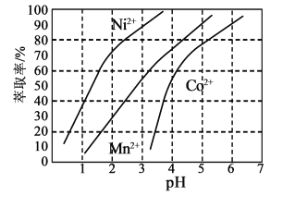
使用该萃取剂时应控制的pH约为____________,理由是_____________。
(4)写出高温煅烧时发生的化学反应方程式___________。
(5)操作1得到的副产品是__________(填名称);
已知该物质的溶液加热到100℃时会变质,该物质的溶解度见下表:
湿度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
溶解度 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 88.0 |
操作1是________(填字母)。
a.蒸发结晶 b.降温结晶 c.减压蒸发结晶
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)晶体的自范性即__________,区分晶体与非晶体最可靠的实验方法是________;
(2)原子间通过共用电子对所形成的相互作用叫做共价键。δ键与π键都属于共价键,δ键的特征是__________,Π键的特征是__________。
(3)Li2O是离子晶体,其晶格能可通过下图的BomHaber循环计算得到。
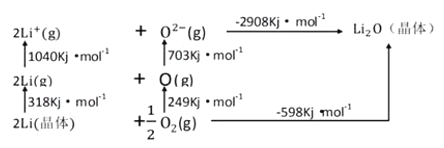
可知,Li原子的第一电离能为__________kJ/mol,O=O键键能为______kJ/mol,Li2O的晶格能为_________ kJ/mol。
(4)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由_______个硼原子组成,共含有__________个BB键。
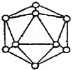
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由1-氯丁烷制取少量的1,2-丁二醇时,需要经过下列哪几步反应
A. 加成→消去→取代B. 消去→加成→水解
C. 取代→消去→加成D. 消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为粗略测定质量为Wg的电石中CaC2的质量分数,利用电石与饱和食盐水反应,实验装置如图所示:
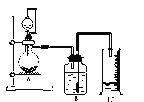
(1)烧瓶中发生反应的化学方程式是_____________
(2)产生的气体分子的中心原子的杂化轨道类型是____________
(3)实验测得量筒中水为VmL,该温度下气体摩尔体积为24.5 L/mol,则电石中CaC2质量分数为___________________
II.俄国化学家马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:![]()
以下是F的合成路线,请填写下列空白:
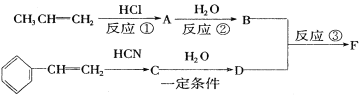
(1)写出C的结构简式______________
(2)B核磁共振氢谱共有__________________组氢
(3)写出③的化学方程式______________
(4)将F与含酚酞的NaOH溶液混合,加热一段时间后,可观察到的颜色变化是__________________
(5)若某有机物G是D的同系物,相对分子质量比D少14,则其分子式为:________;其同分异构体中含苯环且能使石蕊试液变红的物质共有______________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | HCHO | sp2 | 平面三角形 | 三角锥形 |
C | H3O+ | sp2 | 四面体形 | 平面三角形 |
D | NH4+ | sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com