
【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | HCHO | sp2 | 平面三角形 | 三角锥形 |
C | H3O+ | sp2 | 四面体形 | 平面三角形 |
D | NH4+ | sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
【答案】D
【解析】
根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数。
A.SO2中心原子S的价层电子对数=![]() ,杂化方式sp2杂化,价层电子对互斥模型为平面三角形,分子的立体构型为V型结构,A错误;
,杂化方式sp2杂化,价层电子对互斥模型为平面三角形,分子的立体构型为V型结构,A错误;
B.HCHO分子中心原子C的价层电子对数=![]() ,杂化方式sp2杂化,价层电子对互斥模型为平面三角形,分子的立体构型为平面三角形,B错误;
,杂化方式sp2杂化,价层电子对互斥模型为平面三角形,分子的立体构型为平面三角形,B错误;
C.H3O+分子中心原子O的价层电子对数=![]() ,杂化方式sp3杂化,价层电子对互斥模型为四面体形,离子的立体构型为三角锥形,C错误;
,杂化方式sp3杂化,价层电子对互斥模型为四面体形,离子的立体构型为三角锥形,C错误;
D.NH4+分子中心原子N的价层电子对数=![]() ,杂化方式sp3杂化,价层电子对互斥模型为正四面体形,离子的立体构型为正四面体形,D正确;
,杂化方式sp3杂化,价层电子对互斥模型为正四面体形,离子的立体构型为正四面体形,D正确;
故合理选项是D。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是( )

A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+
B.过程②中,Fe3+作氧化剂
C.转化图中化合价不变的元素只有铜和氯
D.回收S的总反应为2H2S+O2=2H2O+2S↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
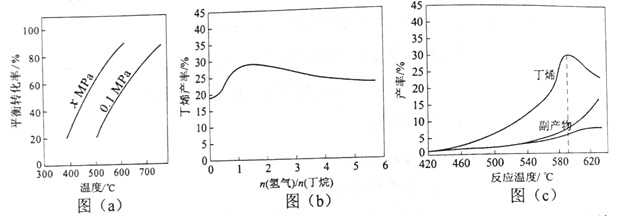
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图。常温下,下列各点所对应溶液中微粒物质的量浓度关系正确的是( )

A.a点:c(N2O22-)+c(HN2O2-)-c(Na+)=9.9×10-7mol·L-1
B.b点:c(Na+)>c(N2O22-)+c(HN2O2-)+c(H2N2O2)
C.c点:c(Na+)>c(HN2O2-)>c(N2O22-)>c(H2N2O2)
D.d点:2c(H2N2O2)+c(HN2O2-)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入物质,发生反应:PCl3(g)+Cl2(g)![]() PCl5(g) ΔH<0,测得反应的相关数据如下:
PCl5(g) ΔH<0,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
温度/℃ | 200 | 300 | 200 |
起始物质投入量 | 1molPCl3、2molCl2 | 2molPCl3、1molCl2 | 2molCl2、2molPCl5 |
平衡c(PCl5)/mol·L-1 | c1 | c2 | c3 |
化学平衡常数 | K1 | K2 | K3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(PCl3) | α2(Cl2) | α3(PCl5) |
下列说法正确的是( )
A.K1<K2
B.c1<c2
C.p3=2p1
D.α1(PCl3)+α3(PCl5)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2为原料可制取电极材料锰酸锂(LiMnxOy),工业上利用菱锰矿粉(MnCO3)制备MnO2的流程如图:
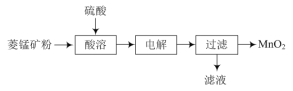
(1)“酸溶”过程中加入过量的硫酸目的是___。
(2)写出“电解”反应的离子反应方程式:___。
(3)为测定LiMnxOy中Mn元素的平均化合价(高于+2价),现进行如下实验:
步骤1:取少量LiMnxOy,分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.400mol·L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol·L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液16.00mL。
步骤3实验过程中物质发生的转化如下,其中C2O42-均转化为CO2:
LiMnxOy![]() Mn2+;MnO
Mn2+;MnO![]()
![]() Mn2+
Mn2+
①步骤3滴定终点时的实验现象是___。
②计算LiMnxOy中Mn元素的平均化合价___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1。下列叙述不正确的是( )
A. 反应中共消耗1.8 mol H2SO4B. 气体甲中SO2与H2的体积比为4∶1
C. 反应中共消耗97.5 g ZnD. 反应中共转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】潮湿环境、Cl-、溶解氧是造成青铜器锈蚀的主要环境因素,腐蚀严重的青铜器表面大多存在起催化作用的多孔催化层。图为青铜器发生电化学腐蚀的原理示意图,下列说法正确的是( )

A.腐蚀过程中,青铜基体是正极
B.若有64gCu腐蚀,理论上耗氧体积为22.4L(标准状况)
C.多孔催化层的形成加速了青铜器的腐蚀速率,是因为改变了反应的焓变
D.环境中的Cl-、正负极产物作用生成多孔粉状锈,其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。

(1)苯甲酸与甲醇反应的化学方程式为______________________________________。
(2)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有___________________________
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是__________________。
(4)用图C装置进行蒸馏提纯时,当温度计显示____________时,可用锥形瓶收集苯甲酸甲酯。
(5)最终制取15g苯甲酸甲酯,计算得苯甲酸甲酯的产率为______________(小数点后保留1位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com