
【题目】用MnO2为原料可制取电极材料锰酸锂(LiMnxOy),工业上利用菱锰矿粉(MnCO3)制备MnO2的流程如图:
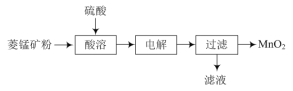
(1)“酸溶”过程中加入过量的硫酸目的是___。
(2)写出“电解”反应的离子反应方程式:___。
(3)为测定LiMnxOy中Mn元素的平均化合价(高于+2价),现进行如下实验:
步骤1:取少量LiMnxOy,分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.400mol·L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol·L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液16.00mL。
步骤3实验过程中物质发生的转化如下,其中C2O42-均转化为CO2:
LiMnxOy![]() Mn2+;MnO
Mn2+;MnO![]()
![]() Mn2+
Mn2+
①步骤3滴定终点时的实验现象是___。
②计算LiMnxOy中Mn元素的平均化合价___(写出计算过程)。
【答案】提高锰元素的浸出率,抑制Mn2+水解 Mn2++2H2O![]() MnO2↓+2H++H2↑ 当加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色 3.5
MnO2↓+2H++H2↑ 当加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色 3.5
【解析】
工业上利用菱锰矿粉(MnCO3)制备MnO2,加入过量硫酸进行酸溶,使矿粉完全反应,提高浸出率,同时酸性环境抑制Mn2+的水解,得到硫酸锰溶液,经过电解,过滤得到MnO2,说明电解过程Mn2+转化为MnO2。
(1)“酸溶”过程中加入过量的硫酸可以提高Mn2+浸出率,同时抑制Mn2+水解;
(2)由分析可知“电解”过程Mn2+转化为MnO2,发生氧化反应,酸性环境,“电解”反应的离子反应方程式:Mn2++2H2O ![]() MnO2↓+2H++H2↑
MnO2↓+2H++H2↑
(3)①步骤3用KMnO4标准溶液滴定,故滴定终点时的实验现象是:当加入最后一滴高锰酸钾溶液,溶液由无色变为浅红色,且半分钟内不褪色;
②取少量LiMnxOy,分成两等份,由步骤二LiMnxOy中Mn元素转化为Mn2+,Mn2+与EDTA反应的化学计量数之比为1∶1,n(Mn2+)=n(EDTA)= 0.400mol·L-1×0.02L=0.008mol,则LiMnxOy中含Mn元素0.008mol;步骤3:通过返滴定,根据氧化还原价态规律可得计量关系: 2MnO![]() ~5Na2C2O4 ,n(MnO
~5Na2C2O4 ,n(MnO![]() )= 0.100mol·L-1×0.016L=0.0016mol,消耗n(Na2C2O4)=0.004mol;2LiMnxOy ~(2y-2x-1)Na2C2O4 ~ 2xMn2+,总共加入Na2C2O4质量1.340g,物质的量0.01mol,由高锰酸钾消耗草酸钠0.004mol,则由LiMnxOy消耗草酸钠n(Na2C2O4)=0.006mol,同时n(Mn2+) =0.008mol,可列出
)= 0.100mol·L-1×0.016L=0.0016mol,消耗n(Na2C2O4)=0.004mol;2LiMnxOy ~(2y-2x-1)Na2C2O4 ~ 2xMn2+,总共加入Na2C2O4质量1.340g,物质的量0.01mol,由高锰酸钾消耗草酸钠0.004mol,则由LiMnxOy消耗草酸钠n(Na2C2O4)=0.006mol,同时n(Mn2+) =0.008mol,可列出![]() ,化简得4y-7x-2=0,由于氧元素的化合价为-2,则可以把等式写成2y=3.5x+1,故Mn平均化合价为+3.5。
,化简得4y-7x-2=0,由于氧元素的化合价为-2,则可以把等式写成2y=3.5x+1,故Mn平均化合价为+3.5。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)晶体的自范性即__________,区分晶体与非晶体最可靠的实验方法是________;
(2)原子间通过共用电子对所形成的相互作用叫做共价键。δ键与π键都属于共价键,δ键的特征是__________,Π键的特征是__________。
(3)Li2O是离子晶体,其晶格能可通过下图的BomHaber循环计算得到。
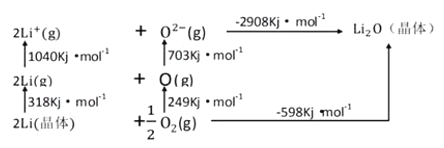
可知,Li原子的第一电离能为__________kJ/mol,O=O键键能为______kJ/mol,Li2O的晶格能为_________ kJ/mol。
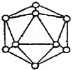
(4)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由_______个硼原子组成,共含有__________个BB键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。完成下列填空:
(1)写出该共聚物的结构简式________。
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体![]() 。写出该两步反应所需的试剂及条件_______、__________。
。写出该两步反应所需的试剂及条件_______、__________。
(3)将![]() 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。A的结构简式为_______。由上述反应可推知_________。由A生成对溴苯乙烯的反应条件为______。
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。A的结构简式为_______。由上述反应可推知_________。由A生成对溴苯乙烯的反应条件为______。
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面,写出B的结构简式_______。设计一条由2,3-二甲基-1-丁烯制备B的合成路线_______。(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | HCHO | sp2 | 平面三角形 | 三角锥形 |
C | H3O+ | sp2 | 四面体形 | 平面三角形 |
D | NH4+ | sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于等于36的Q、W、X、Y、Z五种元素原子序数依次增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是___。
(2)1molQWX与1molWQ2Y所含σ键的比值为___。
(3)根据等电子体理论可以预测WXY-的空间构型为___。
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为___。
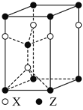
(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为___。
②该化合物所属晶体类型为___晶体,预测其熔点应___金刚石(填“高于”或“低于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
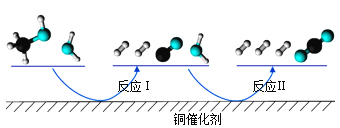

下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NOx的生成和消除是科学家研究的重要课题。
(1)NOx能形成酸雨,NO2转化为HNO3的化学方程式是__。
(2)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) H=+180kJ·mol-1,其能量变化示意图如下:
![]()
则NO中氮氧键的键能是__kJ·mol-1。
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO![]() 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
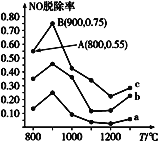
①曲线a对应的n(NH3):n(NO)=__。
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为__mg/(m3·s)。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是__(至少写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2mol O3和3mo lO2的质量之比为:_____,分子数之比为:_______ ,同温同压下的密度之比为:____________。
(2)现在9 g D2O ,若阿伏加德罗常数的值用NA表示,则:该物质的其物质的量为:______,所含质子数为:_____ , 所含中子数为:__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com