
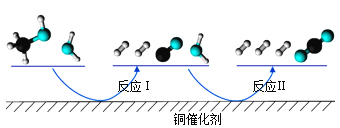
����Ŀ���������Ӧ���ڴ�������ͨ���������������̽��еġ��ҹ�ѧ�߷���T��ʱ�������ʾ�Ϊ��̬�����״���ˮ��ͭ�������ϵķ�Ӧ����������ͼ��ͼ��

����˵����ȷ���ǣ� ��
A.��Ӧ����Ȼ�ѧ����ʽΪ��CO(g)+H2O(g)=H2(g)+CO2(g) ��H=+akJ/mol(a>0)
B.1molCH3OH(g)��1molH2O(g)������������1molCO2(g)��3molH2(g)��������
C.ѡ�������Ĵ������ͷ�Ӧ��͢�Ļ�ܣ������ڼ��ٹ����е��ܺ�
D.CO(g)�ڷ�Ӧ�����������ģ�CO(g)����Ϊ�Ǵ���
���𰸡�C
��������
�ɷ�Ӧ����ͼ��֪����Ӧ��Ϊ��CH3OH =2H2+CO����Ӧ��Ϊ��CO+H2O=H2+CO2��������ͼ��֪����Ӧ��Ϊ���ȷ�Ӧ����Ӧ��Ϊ���ȷ�Ӧ���Ա�����ͼ�з�Ӧ��ķ�Ӧ�������е������ͷ�Ӧ��������������е���������֪��Ӧ��ķ�Ӧ��ͷ�Ӧ��������������е������Ĵ�С��ϵΪ��E������E�����ݴ˽��з�����
A���������ͼ��֪����Ӧ��Ϊ���ȷ�Ӧ�����ݷ�Ӧ����ͼ��֪����Ӧ����Ȼ�ѧ����ʽΪ��CO(g)+H2O(g)=H2(g)+CO2(g) ��H=-akJ/mol(a>0)��A�����
B����Ϸ�Ӧ����������ͼ��֪��E������E������1molCH3OH(g)��1molH2O(g)��������С��1molCO2(g)��3molH2(g)����������B�����
C����������ͨ�����뷴Ӧ�ı䷴Ӧ���̽��ͷ�Ӧ�Ļ�ܣ��Ӷ��ɼ��ٷ�Ӧ���̵��ܺģ�C����ȷ��
D��CO(g)�����м������Ǵ�����D�����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ����
A. ![]()
B. ![]()
C. 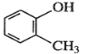 ������
������
D. (CH3)2C��CH(CH2)2CH3 2-��-2-��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ᣨH2N2O2����һ�ֶ�Ԫ�ᣬ�����£���0.01mol��L-1��NaOH��Һ�ζ�10mL0.01mol��L-1��H2N2O2��Һ�������ҺpH��NaOH��Һ����Ĺ�ϵ��ͼ�������£����и�������Ӧ��Һ�������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��

A.a�㣺c(N2O22-)��c(HN2O2-)-c(Na��)=9.9��10-7mol��L-1
B.b�㣺c(Na��)��c(N2O22-)��c(HN2O2-)��c(H2N2O2)
C.c�㣺c(Na��)��c(HN2O2-)��c(N2O22-)��c(H2N2O2)
D.d�㣺2c(H2N2O2)��c(HN2O2-)��c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MnO2Ϊԭ�Ͽ���ȡ�缫��������ﮣ�LiMnxOy������ҵ���������̿�ۣ�MnCO3���Ʊ�MnO2��������ͼ��
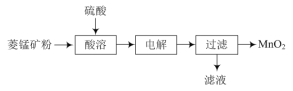
��1���������������м������������Ŀ����___��
��2��д�����������Ӧ�����ӷ�Ӧ����ʽ��___��
��3��Ϊ�ⶨLiMnxOy��MnԪ�ص�ƽ�����ϼۣ����ڣ�2�ۣ����ֽ�������ʵ�飺
����1��ȡ����LiMnxOy���ֳ����ȷݣ��ֱ�������ֻ��ƿ�У�
����2����һֻ��ƿ�м���ϡ�����˫��ˮ����ȫ��Ӧ��LiMnxOy��MnԪ��ת��ΪMn2������ȥ������˫��ˮ������pH���μ�ָʾ������Ũ��Ϊ0.400mol��L-1��EDTA����Һ�ζ����յ�ʱ����EDTA����Һ20.00mL(��֪��Mn2����EDTA��Ӧ�Ļ�ѧ������֮��Ϊ1��1)��
����3������һ��ƿ�м���1.340gNa2C2O4���������ᣬ��ַ�Ӧ����0.100mol��L-1KMnO4����Һ�ζ�������ζ��յ�ʱ����KMnO4����Һ16.00mL��
����3ʵ����������ʷ�����ת�����£�����C2O42-��ת��ΪCO2��
LiMnxOy![]() Mn2+��MnO
Mn2+��MnO![]()
![]() Mn2+
Mn2+
�ٲ���3�ζ��յ�ʱ��ʵ��������___��
�ڼ���LiMnxOy��MnԪ�ص�ƽ�����ϼ�___��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������п��100 mL 18.5 mol��L��1��Ũ�����ַ�Ӧ��п��ȫ�ܽ⣬ͬʱ���������33.6 L(��״��)������Ӧ�����Һϡ����1 L�������Һ��c(H+��=0.1 mol��L��1��������������ȷ����( )
A. ��Ӧ�й�����1.8 mol H2SO4B. �������SO2��H2�������Ϊ4��1
C. ��Ӧ�й�����97.5 g ZnD. ��Ӧ�й�ת��3 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ڼӳɷ�Ӧ����
A.CH2=CH2��HCl![]() CH3CH2ClB.2CH3CH3��5O2
CH3CH2ClB.2CH3CH3��5O2![]() 2CO2��6H2O
2CO2��6H2O
C.CH2=CH2��H2![]() CH3CH3D.CH2=CH2��Br2�D��CH2BrCH2Br
CH3CH3D.CH2=CH2��Br2�D��CH2BrCH2Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʪ������Cl-���ܽ����������ͭ����ʴ����Ҫ�������أ���ʴ���ص���ͭ�����������������õĶ�״��㡣ͼΪ��ͭ�������绯ѧ��ʴ��ԭ��ʾ��ͼ������˵����ȷ���ǣ� ��

A.��ʴ�����У���ͭ����������
B.����64gCu��ʴ�������Ϻ������Ϊ22.4L����״����
C.��״�����γɼ�������ͭ���ĸ�ʴ���ʣ�����Ϊ�ı��˷�Ӧ���ʱ�
D.�����е�Cl-�������������������ɶ��״�⣬�����ӷ���ʽΪ��2Cu2++3OH-+Cl-��Cu2(OH)3Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)��3B(g) ![]() 2C(g)��2D(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ
2C(g)��2D(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ
��v(A)��0.45 mol��L��1��min��1 ��v(B)��0.6 mol��L��1��s��1 ��v(C)��0.4 mol��L��1��s��1 ��v(D)��0.45 mol��L��1��s��1���÷�Ӧ���еĿ���˳��Ϊ
A. ��>�ۣ���>�� B. ��<�ۣ���<�� C. ��>��>��>�� D. ��>��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������ᷴӦ��Ҳ����Ӧ�����ܷ���ˮ�ⷴӦ���ǣ� ��
��![]() �����������
�����������![]() �������ݵ����ʢ���ά�آ�
�������ݵ����ʢ���ά�آ�
A.�٢ڢ�B.�ۢݢ�C.�ܢݢ�D.�٢ۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com