
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
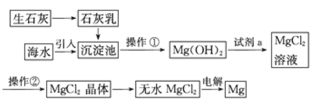
提示:①MgCl2晶体的化学式为MgCl2·6H2O。
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是______,操作②的名称______、_____、过滤。
(2)试剂a的名称是_____。
(3)用氯化镁电解生产金属镁的化学方程式为______。
【答案】过滤 蒸发浓缩 冷却(或降温)结晶 盐酸 MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
(1)分离不溶于水的固体和液体,可用过滤的方法,故操作①的名称是过滤;从沉淀池中得到氢氧化镁用过滤的方法,从氯化镁溶液中得到六水合氯化镁,可以通过蒸发浓缩或冷却结晶的方法获得六水合氯化镁,操作②的名称蒸发浓缩、冷却(或降温)结晶;
故答案为:过滤;蒸发浓缩 冷却结晶(或降温结晶);
(2)从氢氧化镁变为氯化镁,可以采用氢氧化镁和盐酸反应得到,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,加入的足量试剂a是HCl,故试剂a的名称是盐酸,故答案为:盐酸;
(3)由于氧化镁的熔点高,熔融需要较多的能量,成本较高,而氯化镁的熔点较低,所以工业上冶炼镁的方法是电解熔融的MgCl2,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,故反应方程式为:MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
故答案为:MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。


科目:高中化学 来源: 题型:
【题目】某工厂用含淀粉质量分数为76%的陈化粮10.0t来制取乙醇。如果在发酵过程中有81%的淀粉转化为乙醇,制得的乙醇溶液中含乙醇质量分数为40%,则可制得这样的乙醇溶液质量是
A. 8.74 tB. 9.45tC. 9.88tD. 10.25t
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)晶体的自范性即__________,区分晶体与非晶体最可靠的实验方法是________;
(2)原子间通过共用电子对所形成的相互作用叫做共价键。δ键与π键都属于共价键,δ键的特征是__________,Π键的特征是__________。
(3)Li2O是离子晶体,其晶格能可通过下图的BomHaber循环计算得到。
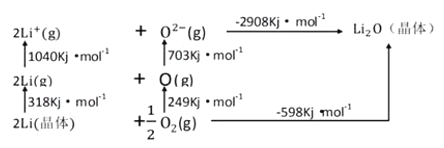
可知,Li原子的第一电离能为__________kJ/mol,O=O键键能为______kJ/mol,Li2O的晶格能为_________ kJ/mol。
(4)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由_______个硼原子组成,共含有__________个BB键。
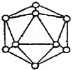
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为粗略测定质量为Wg的电石中CaC2的质量分数,利用电石与饱和食盐水反应,实验装置如图所示:
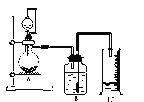
(1)烧瓶中发生反应的化学方程式是_____________
(2)产生的气体分子的中心原子的杂化轨道类型是____________
(3)实验测得量筒中水为VmL,该温度下气体摩尔体积为24.5 L/mol,则电石中CaC2质量分数为___________________
II.俄国化学家马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:![]()
以下是F的合成路线,请填写下列空白:
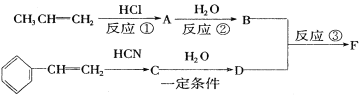
(1)写出C的结构简式______________
(2)B核磁共振氢谱共有__________________组氢
(3)写出③的化学方程式______________
(4)将F与含酚酞的NaOH溶液混合,加热一段时间后,可观察到的颜色变化是__________________
(5)若某有机物G是D的同系物,相对分子质量比D少14,则其分子式为:________;其同分异构体中含苯环且能使石蕊试液变红的物质共有______________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是

选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝色 | Cl2具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。完成下列填空:
(1)写出该共聚物的结构简式________。
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体![]() 。写出该两步反应所需的试剂及条件_______、__________。
。写出该两步反应所需的试剂及条件_______、__________。
(3)将![]() 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。A的结构简式为_______。由上述反应可推知_________。由A生成对溴苯乙烯的反应条件为______。
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。A的结构简式为_______。由上述反应可推知_________。由A生成对溴苯乙烯的反应条件为______。
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面,写出B的结构简式_______。设计一条由2,3-二甲基-1-丁烯制备B的合成路线_______。(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NOx的生成和消除是科学家研究的重要课题。
(1)NOx能形成酸雨,NO2转化为HNO3的化学方程式是__。
(2)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) H=+180kJ·mol-1,其能量变化示意图如下:
![]()
则NO中氮氧键的键能是__kJ·mol-1。
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO![]() 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
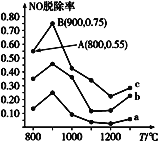
①曲线a对应的n(NH3):n(NO)=__。
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为__mg/(m3·s)。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是__(至少写两条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com