
【题目】某研究小组利用如图装置探究温度对一氧化碳还原氧化铁的影响。
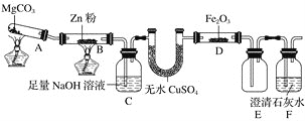
(1)MgCO3的分解产物为____________。
(2)装置C的作用是______________,处理尾气的方法为______________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒类喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验。已知Fe2+与K3[Fe(CN)6](铁氰化钾)溶液反应生成带有特征蓝色的铁氰化亚铁沉淀。
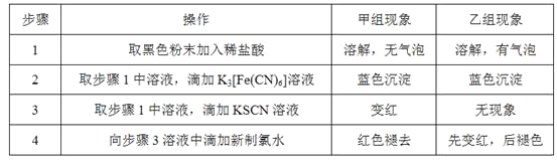
①乙组得到的黑色粉末是______________。
②甲组步骤1中反应的离子方程式为______________。
③乙组步骤4中,溶液变红的原因为______________________;溶液褪色可能的原因及其验证方法为________________________。
④从实验安全考虑,题图装置还可采取的改进措施是__________________________________。
【答案】MgO、CO2 除CO2 点燃 Fe Fe3O4+8H+=2Fe3++Fe2++4H2O Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色 假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立 在装置BC之间添加装置E防倒吸(其他合理答案均可)
【解析】
本题的实验目的是探究温度对一氧化碳还原氧化铁的影响;观察实验装置图,以及(3)题,可以推出D为CO和Fe2O3的反应装置;A为CO2的发生装置,B为将CO2转化为CO的装置,C为CO2的除去装置,以获得纯净的CO;E为防倒吸装置(注意该装置不能用来收集CO,因为该装置收集气体时用的是向上排气法,而CO的密度比空气小,适合向下排气法),D中装有澄清石灰水,则D的作用是检验CO与Fe2O3反应的产物CO2,以证明反应发生。(3)题中,甲、乙使用的热源不同,使得反应的产物也不同,甲组现象中,步骤1无气泡生成,则说明不含Fe;步骤2说明步骤1所得的溶液中含有Fe2+,步骤3说明步骤1所得的溶液中含有Fe3+,由于CO和Fe2O3的产物是纯净物,故可以推出甲组得到的是Fe3O4;而乙组现象中,步骤1有气泡生成,则乙组得到的黑色粉末是Fe,且后续现象也说明了步骤1所得的溶液中不含Fe3+。
(1)根据CaCO3的分解反应,可以推出MgCO3的分解产物为MgO和CO2;
(2)装置C的作用是除去CO2,防止对后续实验结论产生干扰;尾气中CO为有毒气体,可以用点燃的方式处理;
(3)①乙组的现象中,步骤1中有气泡,说明黑色粉末中有Fe,由于该黑色粉末为纯净物,所以乙组得到的黑色粉末为Fe;
②甲组现象中,步骤1无气泡生成,则说明不含Fe;步骤2说明步骤1所得的溶液中含有Fe2+,步骤3说明步骤1所得的溶液中含有Fe3+,由于CO和Fe2O3的产物是纯净物,故可以推出甲组得到的是Fe3O4,则甲组步骤1中反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
③乙组得到的黑色粉末为Fe,在步骤1中溶解变为Fe2+,步骤3中加入KSCN溶液,溶液不会变红,步骤4中加入新制氯水,Fe2+被氧化为Fe3+,Fe3+与SCN-结合为红色物质;红色褪去的原因可能是SCN-被氧化了,验证方法是再加入SCN-,若溶液变为红色,则说明褪色原因是SCN-被氧化;
(4)从安全的角度考虑该实验装置的不足,就是在BC之间没有安全瓶,需要在BC之间再连接一个E装置,以防止倒吸。


科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O![]() H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用甲烷催化还原NOx消除氮氧化物的污染
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
③CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=___(用K1、K2表示)。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
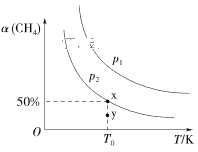
①若容器中的压强为p2,y点:v正____(填“大于”“等于”或“小于”)v逆。
②x点对应温度下反应的平衡常数K=___。
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。
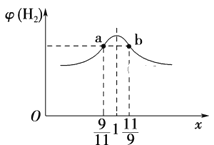
则CH4的转化率:a点____(填“>”“=”或“<”,下同)b点,CH4(g)的浓度:a点_____b点,氢气的产率:a点____b点。
Ⅲ.(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)=SO2(g) +2H2O(l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀(U)是一种稀有金属,制造氢弹的重要原料。提取铀涉及的反应为:UF4+ 2Mg![]() U + 2MgF2。在该反应中,作为还原剂的物质是______,被还原的物质是______;若反应中消耗1 mol Mg,则生成U______mol。
U + 2MgF2。在该反应中,作为还原剂的物质是______,被还原的物质是______;若反应中消耗1 mol Mg,则生成U______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
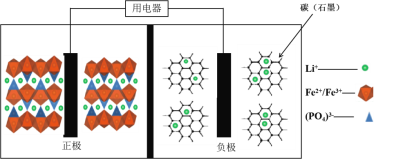
原理如下:(1x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法不正确的是( )
LiFePO4+nC。下列说法不正确的是( )
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
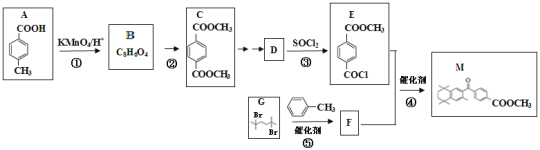
【题目】化合物M是生产治疗皮肤病药物的中间体。实验室由芳香族化合物A制备M的一种合成路线如图:
已知:①RCOOH![]() RCOCl
RCOCl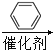
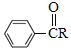
②![]()
![]()
![]() (R表示烃基)
(R表示烃基)
回答下列问题:
(1)B的化学名称为___。
(2)反应②试剂和条件分别为___。
(3)③的反应类型是___。
(4)M中含氧官能团的名称是___。
(5)反应⑤的化学方程式为___。
(6)写出同时满足下列条件,与D互为同分异构体的芳香族化合物的结构简式___(任写两种)。
ⅰ.能与NaHCO3溶液反应;
ⅱ.能发生银镜反应;ⅲ.核磁共振氢谱中的峰面积之比为1:2:2:2:1。
(7)参照上述合成路线和信息,以苯和一溴甲烷为原料(无机试剂任选),设计制备![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com