
【题目】一种可利用含碘废水制取KI的实验流程如下:

回答下列问题:
(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中,_____________。
(2)“制CuI”时,I2被还原为CuI,同时有S4O62-生成。
①该反应的离子方程式为_________________________________________________。
②已知上述反应的平衡常数为1.78×1026,实验中需控制CuSO4过量2%,其目的是_________________。
(3)“制FeI2溶液”的化学方程式为____________________________________;“滤渣3”的成分是________________(填化学式)。
(4)用HI调节溶液pH约为6,其目的是_____________________________________。
(5)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为____________(保留三位有效数字)。
【答案】 加入淀粉及FeCl3溶液,观察溶液是否出现蓝色,或加入AgNO3溶液,看是否有黄色沉淀生成 2Cu2++I2+4S2O32-=2CuI↓+2S4O62- 使碘完全转化为CuI 2CuI+Fe=2CuFeI2 FeCO3 除去滤液中过量的K2CO3 91.3%
【解析】(1)检验碘可以用淀粉也可以用四氯化碳萃取,检验I-时为防止碘的干扰,需先充分萃取出碘再在水层中加入淀粉及氧化剂(FeCl3、H2O2及氯水均可),故证明含有I2,反复萃取后取水层少许于试管中,加入淀粉及FeCl3溶液,观察溶液是否出现蓝色,或加入AgNO3溶液,看是否有黄色沉淀生成;(2)①Na2S2O3 是还原剂,转化为Na2S4O6失去2个电子,则反应的离子方程式为:2Cu2++I2+4S2O32-=2CuI↓+2S4O62-;②该反应平衡常数很大,当Cu2+过量时,能使碘完全转化为CuI;(3)依据金属活动顺序表,铁可还原CuI为Cu;制备KI时发生的复分解反应为FeI2+K2CO3=FeCO3↓+2KI,故滤渣为FeCO3;(4)由于沉淀时K2CO3需适当过量,为提高KI纯度,需用HI溶液除去过量的K2CO3;(5)依据滴定反应:Ag++I-=AgI↓,KI的质量分数为:![]() ×100%=
×100%=![]() ×100%=91.3%。
×100%=91.3%。


科目:高中化学 来源: 题型:
【题目】下列哪一实例能证明微量元素是生命活动所必需的
A. Mg是叶绿素的组成成分 B. 油菜缺少B时只开花不结果
C. 哺乳动物血液中, Ca盐含量太低会抽搐 D. 缺P会影响脂质的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞或细胞器的说法,正确的是( )
A. 只有含有叶绿体的细胞才能进行光合作用
B. 若要判断一个细胞是否为植物细胞,不能仅依据细胞中是否含有叶绿体
C. 用光学显微镜观察不能区分一个细胞是真核细胞还是原核细胞
D. 水和无机盐是细胞中的能源物质之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年,“雾霾”成为年度关键词。近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题:雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(I)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4-7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用子染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:____________。
(2)SO2经过净化后与空气混合进行催化氧化后制取硫酸我者硫酸铵,其中SO2发生催化氧化的反应为:2 SO2 (g)+ O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
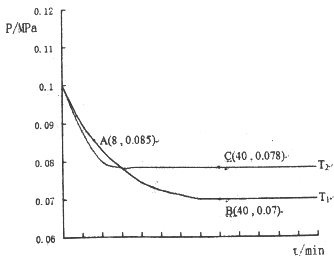
①图中A点时,SO2的转化率为____________。
②计算SO2催化氧化反应在图中B点的压强平衡常数K=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则Tl__T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率VA(逆)的大小关系为vc(正)____VA(逆)(填“>”、“<”、“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将人的成熟红细胞放进蒸馏水中,造成红细胞破裂出现溶血现象,再将溶出细胞外的物质冲洗掉,剩下的结构在生物学上称为“血影”.其主要成分是( )
A. 无机盐、蛋白质 B. 蛋白质、糖类
C. 脂肪、蛋白质 D. 磷脂、蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 维生素C具有还原性,在人体内起抗氧化作用
B. 糖类、蛋白质、油脂属于可水解的天然高分子化合物
C. 煤中含有苯和甲苯,可以先干馏在蒸馏的方法获得苯甲苯等芳香族化合物
D. 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表标出的是元素周期表的一部分元素,回答下列问题:
1 | A | |||||||||||||||||
2 | B | |||||||||||||||||
3 | C | D | E | F | G | H | I | |||||||||||
4 | J | K | ||||||||||||||||
5 | ||||||||||||||||||
6 | ||||||||||||||||||
(1)表中用字母标出的元素中,化学性质最不活泼的是(用元素符号表示,下同),其原子结构示意图为 .
(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式 .
(3)在C、D、E形成的氢氧化物中,碱性最强的是(用化学式表示);在F、G、H形成的氢化物中最稳定的是(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为;它的空间构型是 .
(5)在H、K对应的单质中,氧化性较弱的是(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:

(1)实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为____________。
(2)洗涤沉淀B的操作是__________________________________________________。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为________。

方案Ⅱ.乙组同学的主要实验流程图如下:
按如下图所示装置进行实验:

(4)该实验中装置B盛放的物质是_____________________,分液漏斗中___________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。D装置的作用是_________________。
(6)有的同学认为为了减少实验误差,在反应前后都要通人N2(如下图),

反应后通入N2的目的是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com