
【题目】2013年,“雾霾”成为年度关键词。近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题:雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(I)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4-7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用子染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:____________。
(2)SO2经过净化后与空气混合进行催化氧化后制取硫酸我者硫酸铵,其中SO2发生催化氧化的反应为:2 SO2 (g)+ O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
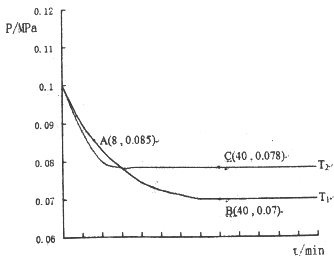
①图中A点时,SO2的转化率为____________。
②计算SO2催化氧化反应在图中B点的压强平衡常数K=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则Tl__T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率VA(逆)的大小关系为vc(正)____VA(逆)(填“>”、“<”、“=”)
【答案】 2HSO3-+ 2H++2e- = S2O42-+2H2O 45% 24300 (Mpa)-1 < >
【解析】(I)电解:阴极上得电子,发生还原反应,2HSO3-+2H++2e-=S2O42-+2H2O;(2)①列出三段式,设氧气消耗物质的量为x,
2SO2(g)+O2(g)![]() 2SO3
2SO3
起始量/mol 2a a 0
变化量/mol 2x x 2x
平衡/mol 2a-2x a-x 2x
图中A点时,气体物质的量0.085,则(2a-2x+a-x+2x)/(2a+a)=0.085/0.1,x=0.45a,SO2的转化率=0.45a×2/2a×100%=45%;②图中B点,列出三段式,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量/mol 2a a 0
变化量/mol 2y y 2y
平衡量/mol 2a-2y a-y 2y
B点气体物质的量为 0.007,则(2a-2y+a-y+2y)/(2a+a)=0.07/0.1,y=0.9a,平衡常数K=((0.007×1.8/(0.2a+0.1a+1.8a))2(0.007×0.2a/(0.2a+0.1a+1.8a))-2×(0.007×0.1a/(0.2a+0.1a+1.8a))-1=24300(MPa)-1。即K=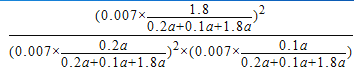 =24300(MPa)-1。③图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)。
=24300(MPa)-1。③图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)。


科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
①化学性质相似的有机物是同系物 ②分子组成相差一个或几个CH2的有机物是同系物 ③若烃中碳、氢元素的质量分数相同,它们必是同系物 ④具有同一通式的物质属于同系物
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人的体液中Ca2+含量过低时,肌肉和神经兴奋性提高而出现抽搐,这一事实说明Ca2+的生理功能之一是 ( )
A. 是细胞结构的组成成分 B. 维持细胞正常的形态
C. 维持细胞正常的生理功能 D. 维持体内的酸碱平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一实例能证明微量元素是生命活动必需的 ( )
A. Mg是叶绿素的组成成分 B. 油菜缺少B时只开花不结果
C. 哺乳动物体内Ca盐含量太低,会抽搐 D. 缺少P会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应又属于氧化还原反应且反应过程中会放出热量的是
A. 甲烷在氧气中的燃烧反应 B. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
C. 灼热的碳与二氧化碳的反应 D. 钠与水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可利用含碘废水制取KI的实验流程如下:

回答下列问题:
(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中,_____________。
(2)“制CuI”时,I2被还原为CuI,同时有S4O62-生成。
①该反应的离子方程式为_________________________________________________。
②已知上述反应的平衡常数为1.78×1026,实验中需控制CuSO4过量2%,其目的是_________________。
(3)“制FeI2溶液”的化学方程式为____________________________________;“滤渣3”的成分是________________(填化学式)。
(4)用HI调节溶液pH约为6,其目的是_____________________________________。
(5)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为____________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 酸、碱、盐均是电解质
B. 不同浓度的同一弱电解质,其电离常数(K)不同
C. 强电解质都是离子化合物,在水溶液中完全电离成离子形式
D. 强电解质的水溶液导电性不一定强于弱电解质的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质溶于水时破坏的作用力描述错误的是
A. 氯化钠,破坏了离子键B. 氯化氢,破坏了共价键
C. 蔗糖,破坏了分子间作用力D. 二氧化碳,没有破坏作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1
B. NA个电子的物质的量是1 mol
C. 在同温同压下,相同体积的任何气体单质所含的分子数目相同
D. H2SO4的摩尔质量(M)是98
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com