
【题目】人的体液中Ca2+含量过低时,肌肉和神经兴奋性提高而出现抽搐,这一事实说明Ca2+的生理功能之一是 ( )
A. 是细胞结构的组成成分 B. 维持细胞正常的形态
C. 维持细胞正常的生理功能 D. 维持体内的酸碱平衡
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醛的结构简式为CH2=CHCHO,下列有关其性质的叙述中错误的是
A.能使溴水褪色,也能使高锰酸钾酸性溶液褪色
B.在一定条件下与H2充分反应,生成1-丙醇
C.能发生银镜反应,且反应过程中表现出氧化性
D.在一定条件下能被空气氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物性质的叙述不正确的是
A. 大多数有机物难溶于水,易溶于有机溶剂
B. 有机物参加的反应比较复杂,一般情况下反应较慢
C. 有机物一般硬度大、熔点高
D. 绝大多数有机物受热易分解,容易燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物广泛用于制造半导体材料以及用于医疗、农药等。回答下列问题:
(1)砷与氮同主族,原子序数比氮大26,则砷在元素周期表中的位置是____________;砷化氢的电子式为______________________。
(2)H3AsO3又叫路易斯酸,是一种弱酸,发生酸式电离是通过和水中的氢氧根离子结合实现的,则第一步电离方程式为____________________________________________;若常温时H3AsO3的第一步电离常数Ka1=1.0×10-9,则常温下,0.1mol·L-1的H3AsO3溶液的pH为_______________。
(3)利用可逆的氧化还原反应AsO![]() +2I-+2H+
+2I-+2H+![]() AsO
AsO![]() +I2+H2O可以设计为原电池,起始时在甲、乙两池中分别加入图示药品并连接装置。
+I2+H2O可以设计为原电池,起始时在甲、乙两池中分别加入图示药品并连接装置。

①起始时,甲池石墨棒C1上发生的电极反应为_____________________。
②一段时间后指针不发生偏转。欲使指针偏转方向与起始时相反,应采取的可行措施是_______________________________________________________________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞或细胞器的说法,正确的是( )
A. 只有含有叶绿体的细胞才能进行光合作用
B. 若要判断一个细胞是否为植物细胞,不能仅依据细胞中是否含有叶绿体
C. 用光学显微镜观察不能区分一个细胞是真核细胞还是原核细胞
D. 水和无机盐是细胞中的能源物质之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面的题目:
(1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是 . 
(2)为防止氯气污染空气,可用溶液吸收多余的氯气,原理是(用化学方程式表示).根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是(填化学式,下同),长期露置于空气中的漂白粉,加入稀盐酸后产生的气体是 .
(3)氯气泄漏时,人们需尽快远离现场,可用浸有一定浓度某物质水溶液的毛巾捂住口鼻,最适宜采用的物质是 .
A.NaOH
B.NaCl
C.KBr
D.Na2CO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年,“雾霾”成为年度关键词。近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题:雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(I)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4-7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用子染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:____________。
(2)SO2经过净化后与空气混合进行催化氧化后制取硫酸我者硫酸铵,其中SO2发生催化氧化的反应为:2 SO2 (g)+ O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
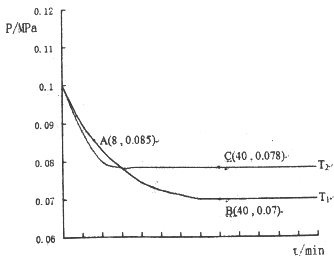
①图中A点时,SO2的转化率为____________。
②计算SO2催化氧化反应在图中B点的压强平衡常数K=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则Tl__T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率VA(逆)的大小关系为vc(正)____VA(逆)(填“>”、“<”、“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com