
【题目】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题:
(1)戊离子的结构示意图为________。
(2)写出乙的单质的电子式:________。
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2∶4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:____________。
(5)按图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:____________。
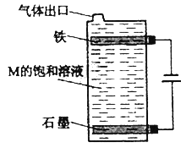
【答案】 ![]()
![]() 2∶3 H++AlO
2∶3 H++AlO![]() +H2O===Al(OH)3↓ NaCl+H2O
+H2O===Al(OH)3↓ NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
【解析】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,甲为H,乙为N;甲、丙处于同一主族,结合原子序数可知,丙为Na;丙、丁、戊处于同一周期,即处于第三周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和,即戊原子最外层电子数为1+1+5=7,则戊为Cl;氯气与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1,则Y为NH4Cl,Z为HCl;丁的单质既能与丙(Na)元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z(HCl)的水溶液反应生成盐,丁为两性金属,则丁为Al元素,故L为NaAlO2;丙、戊组成化合物M为NaCl。
(1)氯离子的结构示意图为![]() ;(2)氮气的电子式为
;(2)氮气的电子式为![]() ;(3)氯气与氨气反应生成NH4Cl、HCl,二者物质的量之比为2:4,该反应方程式为:3Cl2+4NH3=N2+2NH4Cl+4HCl,反应中被氧化的物质是2mol氨气,被还原的物质是3mol氯气,物质的量之比为2:3;(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓;(5)电解饱和氯化钠溶液的的方程式为:NaCl+2H2O
;(3)氯气与氨气反应生成NH4Cl、HCl,二者物质的量之比为2:4,该反应方程式为:3Cl2+4NH3=N2+2NH4Cl+4HCl,反应中被氧化的物质是2mol氨气,被还原的物质是3mol氯气,物质的量之比为2:3;(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓;(5)电解饱和氯化钠溶液的的方程式为:NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O
2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O![]() NaClO+H2↑。
NaClO+H2↑。


科目:高中化学 来源: 题型:
【题目】碳的化合物与人类生产、生活密切相关。
(1)标准状况下,将11.2LCO2通入100mL 1mol/L的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为___________;用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+______。
②c(H+)+c(Na+)=_________。
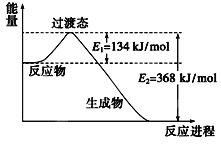
(2)下图是1mol NO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________
(3)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),
Ni(CO)4(g),![]() H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________(填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________(填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,![]() H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(4)二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g)+H2O(l)![]() 2CH3OH(l)△H=+24.52kJ/mol
2CH3OH(l)△H=+24.52kJ/mol
②CH3OH(l)+H2O(l)![]() CO2(g)+3H2(g)△H=+49.01kJ/mol
CO2(g)+3H2(g)△H=+49.01kJ/mol
③CO(g)+H2O(l)![]() CO2(g)+H2(g)△H=-41.17kJ/mol
CO2(g)+H2(g)△H=-41.17kJ/mol
④CH3OH(l)![]() CO(g)+2H2(g)△H=+90.1kJ/mol
CO(g)+2H2(g)△H=+90.1kJ/mol
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,
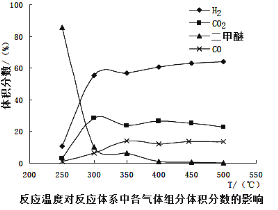
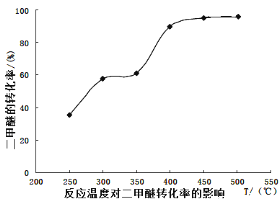
①你认为反应控制的最佳温度应为___________。
A.300~350℃B.350~400℃C.400~450℃D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是___________(用相应的化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 ml 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是( )
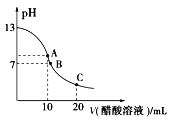
A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B.在B点:c(Na+)﹦c(CH3COO-)﹥c(OH-)﹦c(H+)
C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+)﹥c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)﹦2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]
亲水型功能高分子M和香料N可由如图所示途径合成(部分产物略去):

已知:
①A是芳香烃的含氧衍生物,相对分子质量为108
②有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水
(S)R1CHO + R2CH2CHO![]() R1CH=
R1CH=![]() +H2O
+H2O
请回答下列问题:
(1)E的化学名称_______,C的结构简式 _______;
(2) M中的含氧官能团的名称为_______,A生成B的反应类型________;
(3)写出F到G的第一步化学方程式______________;
(4)同时满足下列条件的G的同分异构体有____种(不考虑立体异构,不计G本身)
①苯环上有四种不同的氢
②能与NaHCO3溶液反应产生气体
③遇氯化铁溶液会显色
④分子中只存在一个环
(5)仿照题中的合成线路图,以乙醇为起始物,无机试剂任选,写出合成聚-2-丁烯醛的线路图:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的NH![]() ,模拟装置如图所示。下列说法正确的是( )
,模拟装置如图所示。下列说法正确的是( )
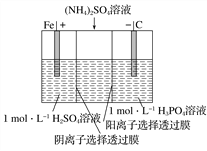
A. 阳极室溶液由无色变成棕黄色 B. 阴极的电极反应式为4OH--4e-===2H2O+O2↑
C. 电解一段时间后,阴极室溶液中的pH升高 D. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化还原反应2Cu(IO3)2+24KI+12H2SO4==2CuI↓+13I2+12K2SO4+12H2O,当1mol氧化剂参加反应时,被氧化的物质的物质的量为
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用惰性电极电解400 mL一定浓度的CuSO4溶液(不考虑电解过程中溶液体积的变化),通电一段时间后。
①若向所得溶液中加入0.1molCuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中总的离子反应方程式为_________。
②若向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为__________mol。
II.把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100mL的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则电路中共转移____________mol电子,此时铝元素以_____________形式存在。(用化学用语作答)
III.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。
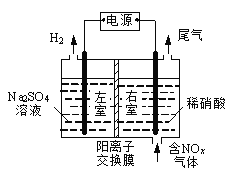
(1) 若用NO2气体进行模拟电解法吸收实验。
① 写出电解时NO2发生反应的电极反应式:__________________。
② 若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+________mol。
(2) 某小组在右室装有10 L 0.2 mol·L-1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 LH2。原气体中NO和NO2的体积比_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。按此规定,下列说法中错误的是( )
A.第15列元素的最高价氧化物的化学式是R2O3
B.第17列元素单质熔、沸点逐渐升高
C.第11列中肯定没有非金属元素
D.在18列元素中,第3列的元素种类最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com