
【题目】下列各组物质形成的晶体中,晶体类型相同的是( )
A.晶体硅和SiC
B.C60和Mg
C.NaCl和HCl
D.SO2和SiO2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。下列有关说法错误的是( )

A. 反应后溶液中含有NO3-
B. 反应后溶液中c(H+)增大
C. 实验过程中有化合反应发生
D. 实验过程中NH3H2O的电离常数不可能发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 2.0gH218O与D2O的混合物中所含中子数为NA
B. 50mL18mol·L-1浓硫酸与足量铜供热,转移电子数为0.9NA
C. 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA
D. 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016江苏卷】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 SO32–的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ + 6HCHO = 3H++ 6H2O + (CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮元素的质量分数为 。(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式___________________ ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应:4C(s)+ 6H2(g)+ O2(g) = 2CH3OCH3(g)的反应热为___________
(2) 工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是___________(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”)
(3) 以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式___ _ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
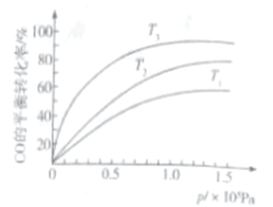
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com