
【题目】1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A. 第三周期第ⅠA族 B. 第三周期第ⅡA族
C. 第四周期第ⅠA族 D. 第五周期第ⅠA族
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】请按照题目要求完成下列填空:
(1)某烃的结构简式为![]() ,分子中可能在同一直线上的碳原子数为_________,一定在同一平面上的碳原子数为_________。该烃与足量H2加成后所得产物的化学名称为___________。
,分子中可能在同一直线上的碳原子数为_________,一定在同一平面上的碳原子数为_________。该烃与足量H2加成后所得产物的化学名称为___________。
(2)人们将连有四个不同基团的碳原子形象地称为手性碳原子,如: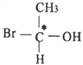 。存在手性碳原子的物质往往具有旋光性。分子式为C4H9C1的同分异构体中具有旋光性的异构体的化学名称为___________。写出以该物质为原料制取1-丁烯的化学方程式____________。
。存在手性碳原子的物质往往具有旋光性。分子式为C4H9C1的同分异构体中具有旋光性的异构体的化学名称为___________。写出以该物质为原料制取1-丁烯的化学方程式____________。
(3)某芳香族化合物的分子式为C8H8O4,它与Na、NaOH、NaHC03反应的物质的量之比依次为:1:3、1:2、1:1,且苯环上的一溴代物有4种。该有机物可能的结构简式为____________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.所有不锈钢都是仅含铁、碳两种元素的含碳较低的铁合金
B.我国流通的硬币材质是某种金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是
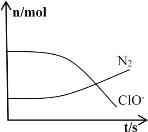
A. 该反应中Cl-为氧化产物
B. 消耗1mol还原剂,转移6mol电子
C. NH4+被ClO-氧化成N2
D. 反应后溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.氯气是黄绿色、有刺激性气味、有毒的气体
B.三氧化二铝是两性氧化物
C.晶体硅用来制作光导纤维
D.焰色反应是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学欲利用CuO与NH3的反应来研究NH3的某种性质并测定其组成,设计的实验装置如图所示(夹持装置已省略)。
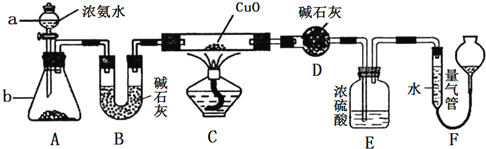
请回答下列问题:
(1)仪器a的名称为______________;仪器b中盛装的试剂为__________________(填名称)。
(2)实验中观察到装置C中黑色CuO粉末变为单质铜,且量气管中有气体单质产生,上述实验现象证明NH3具有____________性,写出相应的化学方程式:_________________________。
(3)装置E中浓硫酸的作用是_________________________________。
(4)实验结束后,若测得干燥管D增重mg,装置F中气体的体积为nL(已折算为标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分別取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液変红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分別取2mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______(填离子符号);实验①和实验③说明:在I-过量的情况下,溶液中仍含有_____(填离子符号);由此可以证明该氧化还原反应为___________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________。生成沉淀的原因是______________(用平衡移动原理解释)。
(6)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液通入标准状况下112mLCl2,恰好将Fe2+完全氧化,则x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为血红色,则下列叙述不正确的是 ( )
A. 原溶液中的Br-不一定被氧化
B. 通入氯气之后原溶液中的Fe2+一定被氧化
C. 不能确定通入氯气之后的溶液中是否存在Fe2+
D. 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com