
【题目】(探究题)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答:
(1)B极是电源的,一段时间后,甲中溶液颜色,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明_________________在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(3)现用丙装置给铜件镀银,则H应是__________,电镀液是__________溶液。
(4)若将C电极换为铁,其他装置都不变,则甲中发生的总反应的离子方程式为:________________。
【答案】(1)负极,变浅,胶粒;(2)1:2:2:2;
(3)铜,AgNO3;(4)Fe+Cu2+=Fe2++Cu。
【解析】
试题分析:(1)乙池电解饱和NaCl溶液,F极变红,说明产生OH-,2H2O + 2e- = H2↑ +2OH- ,F电极为阳极,因此B为正极,A为负极,C为阳极,D为阴极,阳极反应式为:4OH--4e-=2H2O+O2↑,阴极电极反应式:Cu2++2e-=Cu,溶液中Cu2+浓度减小溶液变浅,Fe(OH)3胶粒带正电,胶粒向阴极移动;(2)C极阳极反应式为:4OH--4e-=2H2O+O2↑,D极阴极电极反应式:Cu2++2e-=Cu,E电极反应式:2Cl--2e-=Cl2↑,F电极反应式2H2O+2e-=H2↑+2OH-,此电路是串联电路,通过电量相等,因此单质物质的量之比为1:2:2:2;(3)电镀时,待镀金属作阴极,镀层金属作阳极,铜件作阴极,银单质为阳极,因此H是铜,电镀液含有Ag+,电镀液是AgNO3;(4)活动性金属作阳极,金属先失电子,即Fe-2e-=Fe2+,阴极:Cu2++2e-=Cu,总电极反应式为Fe+Cu2+=Fe2++Cu。


科目:高中化学 来源: 题型:
【题目】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如下:

(1)碘在周期表中的位置为_________________.
(2)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO--的物质的量之比为1 :1,请完成该反应的离子方程式的配平
______I2+______OH-=______IO3- +__IO- +______I- +______H2O
(3)生产流程中加入过量铁屑的目的是______________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是___________________。
(4)溶液2中除含有H+外,一定含有的阳离子是_______________。
(5)已知I-易被空气中的O2氧化,则从溶液1中获得NaI固体的操作依次是__________、_________、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在溶液中不发生化学反应而能共存的是( )
A.Na2SO4、KNO3、Na2CO3、NH4Cl B.H2SO4、BaCl2、Na2SO4、NaOH
C.MgCl2、AgNO3、KNO3、HCl D.NH4HCO3、NaOH、NaCl、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是

A.维持温度、容积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是
A. 34S原子核内中子数为16 B. 16O2比18O2沸点更低
C. 2H+的酸性比1H+的酸性更强 D. 13C和15N原子核内的质子数相差2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在人体中的含量只有0.004%,微乎其微,但铁是组成血红蛋白的一个不可缺少的成员.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁,服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+![]() Fe3+的转化时,①中的Fe2+作 剂;
Fe3+的转化时,①中的Fe2+作 剂;
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作__________剂;
(3)用小苏打片(NaHCO3)治疗胃酸(主要成分盐酸)过多的离子方程式为 ;
如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
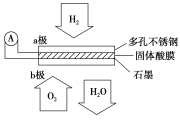
A.电子通过外电路从b极流向a极
B.H+由a极通过固体酸电解质传递到b极
C.b极上的电极反应式为:O2+2H2O+4e-=4OH-
D.每转移0.1 mol电子,消耗1.12 L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1) 可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
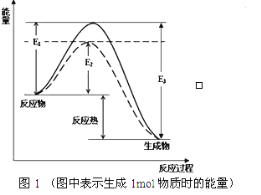
根据图1请写出合成氨的热化学方程式:_______________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li═LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
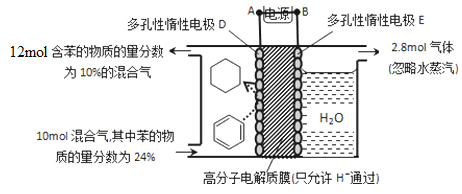
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率![]() =__________________________。
=__________________________。
(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com