
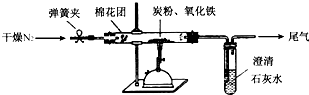
分析 (1)根据过量炭粉与氧化铁反应的气体产物可能有①CO、②CO2、③CO2、CO的混合物得出假设③;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应可以制得氮气;
(4)⑤根据前后两次通入氮气的时间和减小实验误差角度来分析;
(5)根据质量守恒判断气体的组成,根据质量关系计算气体的物质的量之间的关系,进而书写化学方程式;
(6)①根据氢氧化钙和氢氧化钡的本质区别进行分析;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理.
解答 解:(1)过量炭粉与氧化铁反应的气体产物可能有:①CO、②CO2、③CO2、CO的混合物,则假设③为:CO2、CO的混合物,
故答案为:CO2、CO的混合物;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,反应物有NH4Cl和NaNO2,生成物为N2,根据质量守恒还应用水,则反应的化学方程式为:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O,
故答案为:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
(4)如果不排尽空气,那么空气中的氧气会与炭粉反应影响反应后生成气体的组成,所以利用稳定的氮气排空气,最后确保完全吸收,反应后还要赶出所有的CO2,
故答案为:步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收;
(5)3.20g氧化铁的物质的量为=$\frac{3.2g}{160g/mol}$=0.02mol,澄清石灰水变浑浊,说明有CO2气体生成,
则n(CO2)=n(CaCO3)=$\frac{2.0g}{100g/mol}$=0.02mol,m(CO2)=0.02mol×44g/mol=0.88g,
反应后硬质玻璃管和固体总质量变化为1.44g大于0.88g,则生成其气体为CO2、CO的混合物,混合气体中含有CO0.08mol,所以CO、CO2的混合气体物质的量比为4:1,所以方程式为:2C+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO↑+CO2↑,
故答案为:2C+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO↑+CO2↑;
(6)①将澄清石灰水换成Ba(OH)2溶液,这样会使二氧化碳被吸收的更完全,称量时相对误差小,
故答案为:氢氧化钡的溶解度大,浓度大,使二氧化碳被吸收的更完全;
②一氧化碳是一种有毒气体,可以通过点燃进行尾气处理,
故答案为:在尾气出口处加一点燃的酒精灯或增加一尾气处理装置.
点评 本题主要考查的是物质组成与含量的测定、性质实验方案的设计,题目难度中等,涉及离子反应方程式、化学方程式书写、环境保护、实验方案的设计与评价等知识,试题知识点较多、综合性较强,充分考查学生的分析能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-→2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O→SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: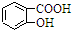 +CO32-→ +CO32-→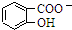 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
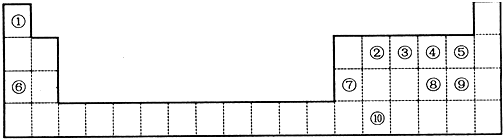
 ,元素②形成的最高价氧化物的结构式为O=C=O;
,元素②形成的最高价氧化物的结构式为O=C=O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④、③ | B. | ④、② | C. | ①、② | D. | ③、① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业用的氯气主要是通过氯碱工业制备 | |
| B. | 金属钠、铁丝和铜丝都可以在氯气中燃烧 | |
| C. | 氢气可以在氯气中燃烧 | |
| D. | 氯气和氢气混合在强光条件下可能会发生爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片与硫酸反应制取氢气时,用98%的硫酸可以加快产生氢气的速率 | |
| B. | 向氯水中加入少量的AgNO3溶液,可使氯气与水反应的平衡向逆反应方向移动 | |
| C. | 洁净的酸(或碱)式滴定管在加入酸(或碱)溶液之前,要用所要盛装的酸(或碱)溶液润洗2-3次 | |
| D. | 常温下,向饱和硫酸钙溶液中加入碳酸钠溶液一定会有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com