
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
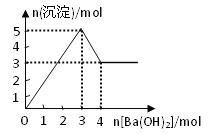
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
【答案】C
【解析】A、氢氧化镁不溶于氢氧化钡溶液,沉淀量达最大后,再加氢氧化钡溶液,沉淀量不变,故A错误;
B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH﹣=AlO2﹣+2H2O可知沉淀中Al(OH)3为2mol,故KAl(SO4)2为2mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH﹣)=2mol:6mol=1:3,发生反应Al3++3OH﹣═Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,再加入氢氧化钡,又生成硫酸钡,且氢氧化铝会逐渐溶解,最终沉淀为4mol,故B错误;
C、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH﹣=AlO2﹣+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH﹣)=2mol:6mol=1:3,发生反应Al3++3OH﹣═Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,故C正确;
D、偏铝酸钠与氢氧化钡不反应,不能产生沉淀,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】右图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图。据图判断下列说法不正确的是( )
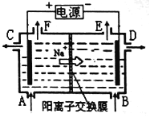
A.标准状况下,生成22.4LCl2的同时有2molNaOH生成
B.从C口流出的是NaOH溶液
C.从E口逸出的气体是H2
D.从F口逸出的气体是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对某绿矾样品进行了如下探究,请回答下列有关问题:
(1)在试管中加入少量该绿矾样品,加水溶解,分别滴加稀硫酸和KSCN溶液,溶液颜色无明显变化,由此得出的结论是_______。若向试管中继续通入空气,观察到溶液逐渐变红,说明溶液中的Fe2+转化为______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

① 仪器B的名称是_________;B中可加入下列试剂中的_______。(填标号)
a.Al2O3 b.Ca(OH)2 c.CuSO4 d.NaCl
②打开K1和K2,缓缓通入N2,点燃酒精灯,加热,接下来的实验操作步骤正确排序是______(填标号)。
a.熄灭酒精灯 b.关闭K1和K2 c.称量A d.冷却到室温
③重复上述操作步骤,直至A恒重,记为m3 g。此时,A中发生的化学反应方程式为___________;计算绿矾化学式中结晶水数目x=____(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在元素周期表中对应的位置(以下为周期表的一部分)。
(2)B元素处于周期表中第_______周期第________族。
(3)B的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物反应的离子方程式为_______________。
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是__________(填化学式)。
(5)C、E形成的化合物有__________(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③Cu ④蔗糖 ⑤NH3 ⑥KNO3溶液 ⑦CO2 ⑧熔融的KCl ⑨石墨。填空回答(填序号):以上物质中能导电的是______________;属于电解质的是__________;属于非电解质的是______________;
(2)用“双线桥”表示出反应中电子转移的方向和数目:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O_______
(3)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐为重要化合物。高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一种电解法制取Fe(OH)2的实验装置(如图)。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是( )
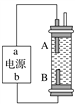
A. 电源中a为负极,b为正极
B. 电解池中的电解液不可以是NaCl溶液
C. B电极发生的反应:2H++2e-===H2↑
D. A、B两端都必须使用铁作电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。
(1)常温下,可用铁或者铝制的容器盛放浓硝酸,说明浓硝酸具有________ 性
A.酸性 B.强氧化性 C.吸水性 D.脱水性
(2)浓H2SO4能够用于干燥某些气体,是由于它具有_____性;下列气体能用浓硫酸来进行干燥的是_____
①Cl2 ②H2S ③CO2 ④NH3 ⑤SO2
(3)浓H2SO4能使纸片变黑,是由于它具有____性;
(4)在加热条件下铜与浓硫酸反应,浓硫酸表现性质为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极,e、f是小试管。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。
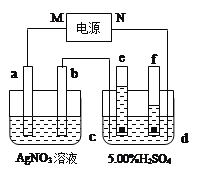
请回答下列问题:
(1)直流电源中,M为_______极。
(2)Pt电极上生成的物质是_______,其质量为______g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:__________。
(4)AgNO3溶液的浓度________(填增大、减小或不变。下同),H2SO4溶液的pH_________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是__________________________。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_____________________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com