
| A. | X、Y的单质均具有较高的熔沸点 | |
| B. | Z、W形成的化合物中既含有离子键,有含有共价键 | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X |
分析 X、Y、Z、W是原子序数依次增大的短周期主族元素,X是组成有机物的基本骨架元素,则X为C元素;元素Z的最高正化合价为+2价,处于IIA族,原子序数大于碳,则Z为Mg;元素Y的核电荷数等于W原子的最外层电子数,由于主族元素原子最外层电子数不超过7,则Y的原子序数大于碳、小于Mg,则Y为N元素、W为Cl元素,结合元素周期律与物质的结构性质判断.
解答 解:X、Y、Z、W是原子序数依次增大的短周期主族元素,X是组成有机物的基本骨架元素,则X为C元素;元素Z的最高正化合价为+2价,处于IIA族,原子序数大于碳,则Z为Mg;元素Y的核电荷数等于W原子的最外层电子数,由于主族元素原子最外层电子数不超过7,则Y的原子序数大于碳、小于Mg,则Y为N元素、W为Cl元素.
A.Y单质氮气,熔沸点很低,故A错误;
B.Z、W形成的化合物为MgCl2,只含有离子键,包含共价键,故B错误;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Z(Mg)>X(C)>Y(N),故C错误;
D.W、Y、X最高价氧化物对应水化物分别为高氯酸、硝酸、碳酸,酸性由强到弱,故D正确.
故选:D.
点评 本题考查原结构性质位置关系应用,推断元素是解题关键,理解掌握元素周期律及其应用.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| 时间/m i n | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.2 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
| A. | 当容器中气体的密度不变时,该反应达到平衡状态 | |
| B. | 用SO3表示0~4 min内该反应的平均速率为0.01 mol/(L•m i n) | |
| C. | 升高温度时,逆反应速率大于正反应速率,平衡常数K值会减小 | |
| D. | 平衡时再通入18O2,平衡右移,达新平衡时,18O仅存在于O2和SO3中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
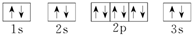 ;D
;D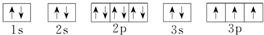 .
.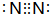 ,氢化物
,氢化物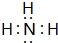 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数等于或大于4的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是金属元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定位于第二周期 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙元素的族序数比甲元素的族序数大 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 | |
| C. | 原子半径由大到小的顺序为:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次减弱 | B. | Cl2、Br2、I2氧化性依次增强 | ||
| C. | Be、Mg、Ca与盐酸反应越来越剧烈 | D. | P、S、Cl最高正价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
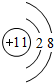 ,最活泼的非金属元素是F (填元素符号,下同),Ar是最不活泼的元素.
,最活泼的非金属元素是F (填元素符号,下同),Ar是最不活泼的元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 关于该粒子的说法不正确的是( )
关于该粒子的说法不正确的是( )| A. | 核电荷数为17 | B. | 核外有3个电子层 | ||
| C. | 属于非金属元素原子 | D. | 在化学反应中容易失去1个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com