
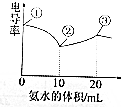
 电导率可用于衡量电解质溶液导电能力的大小.室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100mol/L的盐酸和醋酸的混合液,电导率曲线如图所示.下列说法错误的是( )
电导率可用于衡量电解质溶液导电能力的大小.室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100mol/L的盐酸和醋酸的混合液,电导率曲线如图所示.下列说法错误的是( )| A. | ①点溶液中c(H+)为0.200 mol/L | |
| B. | ②点溶液中c(Cl-)>c(NH4+)>c(Ac-) | |
| C. | ①点溶液中n(所有离子)之和>③点溶液n(所有离子)之和 | |
| D. | ③点后会出现pH=7的点,此点溶液中c(NH4+)=c(Ac-)+c(Cl-) |
分析 A.醋酸是弱酸,在水中不能完全电离,所以不能根据酸的浓度确定氢离子浓度;
B.②点溶液中,溶质为等浓度的醋酸与氯化铵,铵根离子水解浓度会减小;
C.①点溶液中溶质为醋酸和HCl,醋酸部分电离;
D.根据电荷守恒分析.
解答 解:A.醋酸是弱酸,在水中只有部分电离,导致氢离子浓度小于醋酸的浓度,所以该混合溶液中氢离子浓度小于0.200 mol/L,故A错误;
B.②点溶液中,溶质为等浓度的醋酸与氯化铵,铵根离子水解浓度会减小,所以c(Cl-)>c(NH4+),则溶液中c(Cl-)>c(NH4+)>c(Ac-),故B正确;
C.①点溶液中溶质为醋酸和HCl,醋酸部分电离,③点溶液溶质为氯化铵和醋酸铵,二者为强电解质完全电离,所以①点溶液中n(所有离子)之和<③点溶液n(所有离子)之和,故C错误;
D.③点后会出现pH=7的点,溶液中电荷守恒为c(NH4+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-),溶液显中性,则c(H+)=c(OH-),所以此点溶液中c(NH4+)=c(Ac-)+c(Cl-),故D正确.
故选AC.
点评 本题考查了弱电解质的电离,难度较大,明确溶液的电导率有离子浓度有关,浓度越大电导率越大.


 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、${\;}_{1}^{3}$H2 | B. | ${\;}_{6}^{12}$C、${\;}_{6}^{14}$C | ||
| C. | D2O、H2O | D. | 金刚石、石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
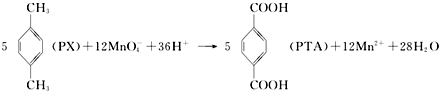
| A. | PTA是该反应的氧化产物 | |
| B. | PTA与乙二醇通过加聚反应即可生产PET塑料 | |
| C. | PX分子含有苯环的同分异构体还有3种 | |
| D. | 该反应消耗 1molPX,共转移12NA个电子 (NA为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3 | B. | NO2 | C. | Al2O3 | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的化学方程式为:CO+H2O?CO2+H2 | |
| B. | 升高温度,v(正)、v(逆)都增大,且v(逆)增大更多 | |
| C. | 缩小容器体积,v(正)、v(逆)都增大,且v(正)增大更多 | |
| D. | 升高温度或缩小容器体积,混合气体的平均相对分子量都不会发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
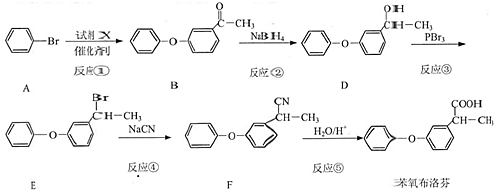
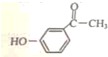 .
.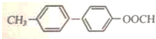 .
.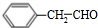 为原料制备
为原料制备 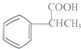 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: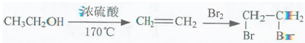
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性介质中钢铁容易发生析氢腐蚀,随着pH升高发生吸氧腐蚀的几率增大 | |
| B. | 电解水制氢比光催化还原水制氢更节能环保、更经济 | |
| C. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素时可用超临界CO2作萃取剂 | |
| D. | 钙基固硫和NOx的催化转化都是解决空气污染问题的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com