
 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
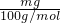 =0.01m mol,故样品中碳酸氢钠质量为0.01m mol×84g/mol=0.84m g,故碳酸氢钠的纯度为
=0.01m mol,故样品中碳酸氢钠质量为0.01m mol×84g/mol=0.84m g,故碳酸氢钠的纯度为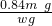 ×100%=
×100%= ×100%,
×100%, ×100%;
×100%;

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示: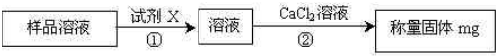
| 21m |
| 25w |
| 21m |
| 25w |
查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:043
工业制备纯碱的方法是氨碱法.其主要过程是:
①冷却时将氨气通入食盐水,制得饱和的氨化盐水;②在加压时通入CO2,发生反应:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
然后将滤出的小苏打焙烧制得纯碱:
2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
母液中的NH4Cl可加入Ca(OH)2回收氨,反应为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,但大量生成的CaCl2用途不大,难以处理.1942年我国化学家侯德榜发明了侯氏制碱法,对氨碱法进行了改进.他将析出NaHCO3后的母液于5~10℃加入食盐粉末,使原来不易结晶的NH4Cl析出晶体,供化肥和其他工业使用.侯氏制碱法成为世界上生产纯碱的重要方法.通过上面资料回答:
(1)氨碱法除回收NH3循环使用外,还有哪些物质可回收使用?
(2)侯氏制碱法除不必生产难以处理的CaCl2外,从原料NaCl的利用上分析,最主要的显著优点为________________________________________.
(3)氨碱法及侯氏制碱法都要用到有关物质的溶解度数据,现列出下表:(单位:g/100g H2O)

a.为什么侯氏制碱法使NH4Cl晶体析出选在5~10℃?
b.氨碱法在②中反应温度在20℃左右,为什么会有NaHCO3晶体析出?
查看答案和解析>>
科目:高中化学 来源:2008-2009学年安徽省宿州二中高三(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
(08福建省实验中学质检)
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:

某兴趣小组欲测定上述反应所制得的样品中碳酸氢钠的纯度,设计了如下两种方案:
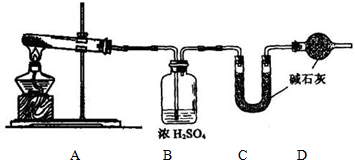
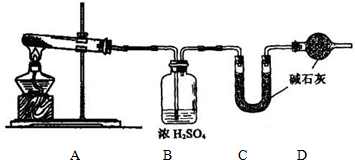
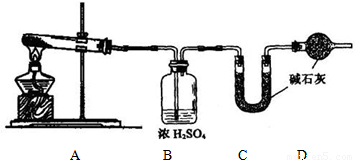
(1)方案一:称取一定质量样品按下图装置(气密性完好)进行实验。

①装置B的作用是_________________________________________________
②装置D的作用是_________________________________________________
③实验中需要称量的装置是______________ (填写字母)
(2)方案二:取w g样品溶于水后,进行下图所示实验:

①试剂X是__________;
②步骤②加入![]() 溶液后的主要操作包括__________、洗涤、_________、称量
溶液后的主要操作包括__________、洗涤、_________、称量
③样品中碳酸氢钠的纯度为_______________________(用含w、m的代数式表示)。
(3)上述方案一测定的结果偏小,可能的原因是__________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com