
【题目】在锌、氧化锌、碳酸锌、盐酸和氯化钙溶液五种物质中,每两种物质反应能生成氯化锌的组合有( )
A.2种B.3种C.4种D.5种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
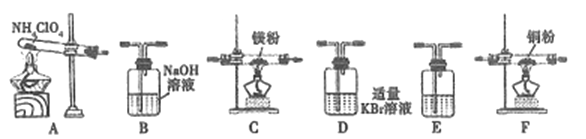
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:

步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应: 2SO2(g)+O2(g)═2SO3(g),此反应放热。2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请填写下列空白:
①从反应开始到达化学平衡,生成SO3的平均反应速率为_______;平衡时,SO2 转化率为 _____
②下列叙述能证明该反应已达到化学平衡状态的是 _________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2 的同时生成nmolO2
F.混合气体密度不再变化
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2。请回答下列问题:
①电池的负极材料为______,发生的电极反应为______;
②电池正极发生的电极反应为______;
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是____,反应的化学方程式为______
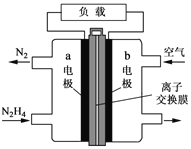
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为 ______ ,正极反应式为 ____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 青铜、碳素钢和石英都是合金
B. 陶瓷、玻璃和水泥都是无机非金属材料
C. 乙醇与乙醛互为同分异构体,都能发生银镜反应
D. 油脂皂化和蛋白质水解都是由高分子生成小分子的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)又称肼,是一种良好的火箭燃料,与适量氧化剂混合可组成液体推进剂,无水N2H4液体有微弱氨气的气味。
(1)N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-622 kJ/mol,试计算1 mol气态肼与二氧化氮完全反应时放出的热量为_______。
(2)在加热条件下,液态肼可还原新制的Cu(OH)2制备纳米级Cu2O,并产生无污染气体,试写出该反应的化学反应方程式_______________________________。
(3)以气态肼为原料的碱性燃料电池的总反应为N2H4+O2=N2+2H2O,放电时负极的反应方程式为______________________________
(4)肼的性质与氨气相似,易溶于水,可发生两步电离过程,第一步电离过程 N2H4+H2O![]() N2H5++OH-,试写出第二步电离过程____________________________。常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中水电离出的c(H+)=_______________。
N2H5++OH-,试写出第二步电离过程____________________________。常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中水电离出的c(H+)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是常见的无机强酸,是重要的化工原料。实验室模拟硝酸的制备可用以下装置,其中a为一个可持续鼓入空气的橡皮球,b、c为止水夹。

(1)实验开始前,应检验装置的气密性,请写出检验A~E装置(不必考虑a)的气密性方法________________。
(2)装置A中发生反应的化学方程式为___________。装置C中浓硫酸的作用是__________。
(3)实验进行一段时间,待制备一定量硝酸后,停止加热A和B中装置,但仍要通过a鼓入一定量的空气,该操作的目的是____________________。
(4)若F装置中所选用试剂为酸性KMnO4溶液,请写出F装置处理NO尾气的离子方程式:_____________________。
(5)欲使A中产生的氨气尽可能转化为硝酸,理论上氨气与鼓入空气的最佳比例为_______。
(6)实验完毕后,取E中的溶液,加入几滴酚酞溶液,用0.10 mol/L的NaOH标准液滴定,发现加入过量标准液后仍无现象,试解释没有观察到滴定终点的原因_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,已知有机物A 的一种同系物的产量,是衡量一个国家石油化工水平的标志,且0.1mol A在足量的氧气中完全燃烧,生成0.3 mol CO2和0.3 mol水。B和D都是有机物,E是具有浓郁香味、不易溶于水的油状液体。
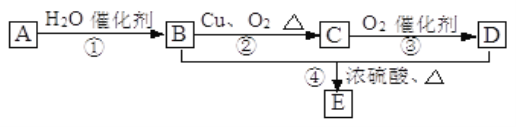
已知:-CHOH最终不能被氧化为—COOH
(1)写出A的结构简式_______。
(2)写出B的结构简式为_______,D中官能团的名称为_______。
(3)写出下列反应的类型:①_______,④_______。
(4)写出下列物质转化的化学方程式: B→C _________ ;B+D→E ______________。
Ⅱ.在实验室可以用如图所示的装置进行B与D的反应,请回答下列问题:

(1)装置中通蒸气的导管要在试管中液面的上方,该溶液的作用是_______。
(2)若要把制得的E分离出来,应采用的实验操作是_______。
Ⅲ. 苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图所示,请回答下列问题:
![]()
(1)在一定条件下,苹果酸可能与下列哪些物质发生反应?_______
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
(2)0.1 mol苹果酸与足量金属钠反应,能生成标准状况下的氢气_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验。
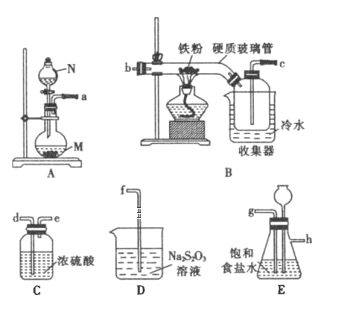
已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600℃的铁屑中通入氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
(1)仪器N的名称是________。N中盛有浓盐酸,烧瓶M中的固体试剂是________(填化学式)。实验室配制FeCl3溶液时需将FeCl3固体溶于较浓的盐酸中,其原因是 ______(用离子方程式表示)
(2)装置的连接顺序为________→________→________→________→________→________→________→d→e→f。(用小写字母表示,部分装置可以重复使用)
(3)若缺少装置E,则对本实验造成的影响是________。
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中发生反应的离子方程式为______________________。
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
![]()
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是________(用离子方程式表示)。
②已知红色褪去的同时有气体生成,经检验气体为O2。该小组对红色褪去的原因进行探究。
实验 | 操作 | 现象 | |
实验Ⅰ(取褪色后溶液3等份) | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
第3份 | 滴加稀盐酸和BaCl2溶液 | 产生白色沉淀 | |
实验Ⅱ(取与褪色后的溶液浓度相同的FeCl3溶液) | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
由实验Ⅰ和Ⅱ可得出的结论为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com