
| A. | 断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量 | |
| B. | X和Y的总能量一定高于M和N的总能量 | |
| C. | Y的能量一定高于N | |
| D. | 因为该反应为放热反应,故不必加热就可发生 |
分析 反应X+Y=M+N为放热反应,则反应物的总能量比生成物的总能量高,以此来解答.
解答 解:A.反应物的总能量大于生成物的总能量,断裂X和Y的化学键所吸收的能量一定小于形成M和N的化学键所放出的能量,故A错误;
B.该反应为放热反应,所以反应物的总能量大于生成物的总能量,即X和Y的总能量一定高于M和N的总能量,故B正确;
C.反应物的总能量大于生成物的总能量,Y的能量不一定高于N,故C错误;
D.反应的放热、吸热与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反应,故D错误.
故选B.
点评 本题考查放热反应与反应物和生成物的总能量的关系,为高频考点,侧重于学生的分析能力的考查,注意信息中反应为放热反应来解答,难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过品红溶液 | |
| B. | 先通过氢氧化钠溶液,再通过澄清石灰水 | |
| C. | 先通过饱和碳酸氢钠溶液,再通过澄清石灰水 | |
| D. | 先通过酸性高锰酸钾溶液,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
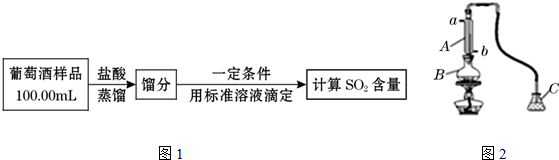
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
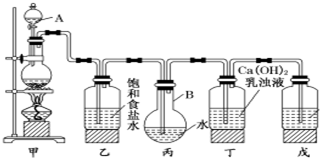
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 生石灰能与水反应,可用来干燥氯气 | |
| D. | 氯化铝是由金属元素和非金属元素组成的化合物,属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物 | |
| B. | 在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物 | |
| C. | 在H2O跟ICl的反应中,ICl 既是氧化剂又是还原剂 | |
| D. | 在H2O跟ICl的反应中,ICl是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com