
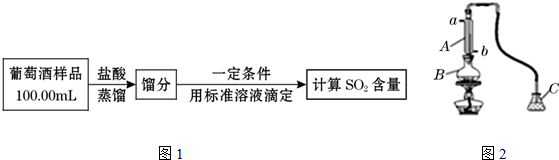
分析 (1)若C中盛装H2O2溶液,二氧化硫具有还原性,能够与过氧化氢反应生成硫酸,据此写出反应的化学方程式;,证明反应生成可以验证生成的硫酸,加入氯化钡溶液生成白色沉淀设计检验方法,氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;
(2)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(3)由于蒸馏时盐酸易挥发,消耗盐酸增多,该测定结果比实际值高,应改为难挥发性的硫酸;
(4)改用0.01000mol•L-1标准I2溶液滴定,选择淀粉溶液做指示剂,滴入最后一滴溶液变蓝色半分钟不变化证明反应达到终点.
解答 解:(1)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,证明上述反应发生的实验方法是:取上述反应液少量于试管中,向其中加入BaCl2溶液,产生了白色沉淀,氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:将下端尖嘴上翘,挤压玻璃珠,
故答案为:SO2+H2O2=H2SO4,取上述反应液少量于试管中,向其中加入BaCl2溶液,产生了白色沉淀,将下端尖嘴上翘,挤压玻璃珠;
(2)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:$\frac{0.032g}{0.1L}$=0.32g/L,
故答案为:0.32;
(3)由于蒸馏时盐酸易挥发,测定过程中消耗盐酸量增多,所以该测定结果比实际值高,改进实验方案时可将盐酸改为难挥发的稀硫酸,
故答案为:偏高;稀硫酸;
(4)改用0.01000mol•L-1标准I2溶液滴定,选择淀粉溶液做指示剂,滴定终点的现象是:滴入最后一滴溶液变蓝色半分钟不变化证明反应达到终点,
故答案为:淀粉溶液;最后一滴标准液加入时,溶液恰好由无色变为蓝色,半分钟内不褪色.
点评 本题为考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应,转移的电子数一定为0.2NA | |
| B. | 标准状况下,22.4L SO3中含有氧原子数为3 NA | |
| C. | 标准状况下,18g H2O中含有氧原子数为NA | |
| D. | 5.4g 铝单质与足量NaOH溶液反应,转移电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量 | |
| B. | X和Y的总能量一定高于M和N的总能量 | |
| C. | Y的能量一定高于N | |
| D. | 因为该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打断amol的N-H键同时消耗a/6mol的尿素 | |
| B. | 密闭容器中混合气体的平均摩尔质量保持不变 | |
| C. | 密闭容器中混合气体的密度保持不变 | |
| D. | 密闭容器中二氧化碳的体积分数保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ba2+、HCO3-、NH4+、NO3- | ||
| C. | K+、Cu2+、Cl-、OH- | D. | Na+、CO32-、SO42-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com