
����Ŀ���ɽ�������PCL�Ľṹ�ɱ�ʾΪ: .��ϳ�·������:
.��ϳ�·������:

��֪:
��![]()
![]()
![]()
��![]()
![]()
![]()
�ش���������:
��1��D�Ľṹ��ʽ��_______________��
��2��M�ķ��ӽṹ����֧����M����D�ķ�Ӧ������_________________��
��3��E��D��ͬ���칹����������ͬ�Ĺ����š�E�Ľṹ��ʽ��________��
��4������˵����ȷ����_____________��
a.Kû��˳���칹
b.M��һ�������¿ɷ����ۺϷ�Ӧ
c.PCL�Ľṹ�к�������
��5��H����������������Һ��Ӧ�Ļ�ѧ����ʽ��_____________________��
���𰸡�  ������Ӧ��ȡ����Ӧ��
������Ӧ��ȡ����Ӧ�� 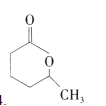 bc
bc ![]()
![]()
��������������������������������ӳɷ�Ӧ����B��B�ǻ�������������������Ϊ![]() ��������ʾ��
��������ʾ��![]() ��������ᷴӦ��������D��D��
��������ᷴӦ��������D��D�� ���������⣬E��D��ͬ���칹�壬E����Ԫ�����Һ�����ͬ�Ĺ����ţ�E��
���������⣬E��D��ͬ���칹�壬E����Ԫ�����Һ�����ͬ�Ĺ����ţ�E��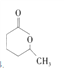 ��Eˮ������F��F��CH3CH(OH)CH2CH2CH2COOH��F������ȥ��Ӧ����G��G��CH3CH=CHCH2CH2COOH��������ʾG������H��H�Ľṹ��ʽ��CH2BrCH=CHCH2CH2COOH��H�е���ԭ��ˮ��ΪK��K��CH2(OH)CH=CHCH2CH2COOH��K�������ӳ�����M��M��CH2(OH)CH2CH2CH2CH2COOH�����ͨ��������Ӧ����D��
��Eˮ������F��F��CH3CH(OH)CH2CH2CH2COOH��F������ȥ��Ӧ����G��G��CH3CH=CHCH2CH2COOH��������ʾG������H��H�Ľṹ��ʽ��CH2BrCH=CHCH2CH2COOH��H�е���ԭ��ˮ��ΪK��K��CH2(OH)CH=CHCH2CH2COOH��K�������ӳ�����M��M��CH2(OH)CH2CH2CH2CH2COOH�����ͨ��������Ӧ����D��
�������������Ϸ�������1��D�Ľṹ��ʽ��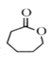 ��
��
��2��CH2(OH)CH2CH2CH2CH2COOH�����ڵ��ǻ����Ȼ�����������Ӧ����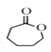 ����Ӧ������������Ӧ��
����Ӧ������������Ӧ��
��3��E��D��ͬ���칹����������ͬ�Ĺ����š�E�Ľṹ��ʽ��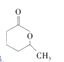 ��
��
��4��a. CH2(OH)CH=CHCH2CH2COOH���� ��
��![]() ���ֽṹ����a������
���ֽṹ����a������
b. CH2(OH)CH=CHCH2CH2COOH����̼̼˫���������ǻ������Ȼ���������һ�������¿ɷ����ۺϷ�Ӧ����b��ȷ��
c. PCL�ĽṹΪ: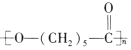 �������ǻ����Ȼ�����������Ӧ���ɵĸ߾������ṹ�к�����������c��ȷ��
�������ǻ����Ȼ�����������Ӧ���ɵĸ߾������ṹ�к�����������c��ȷ��
��5��CH2BrCH=CHCH2CH2COOH����������������Һ��Ӧ�Ļ�ѧ����ʽ��![]()
![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��5%��H2O2��Һ����һ��̽��ʵ�飬ʵ�鲽�����£�����1���ֱ���2֧��С��ͬ���Թ�1���Թ�2��װ��3.0mL5%��H2O2��Һ��
����2���ٷֱ�����֧�Թ��е���1��2��1mol/LFeCl3��Һ��
���Թ��о����������ݳ���ʱ�����Թ�1����ʢ���¶Ⱥ㶨Ϊ5����ˮ���ձ��У��Թ�2����ʢ���¶Ⱥ㶨Ϊ40����ˮ���ձ��У�ͬʱ����ˮ���ռ����������壬����¼��ͬʱ�̣�min��������������mL�����������£�
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
�Թ�1 | 17.5 | 34.9 | 50.1 | 60.3 | 70.4 | 80.2 | 84.9 | 85.2 | 85.4 |
�Թ�2 | 21.7 | 41.2 | 57.5 | 70.8 | 81.3 | 84.9 | 85.3 | 85.4 | 85.4 |
��1�����Թ��м����FeCl3��Һ������ �� д������FeCl3��Һ�����Ļ�ѧ��Ӧ����ʽ����
��2����ͬʱ���Թ�2���ռ���������������Թ�1�ж��ԭ���ǣ� �� �ɴ˸�ͬѧ���Եó���ʵ������ǣ���
��3���Ա�ÿ�������ռ�������������仯��ǰ5������ÿ�����ռ��������������С��ԭ���ǣ���
��4�����õ�λʱ�����ռ��������������ʾ��Ӧ�Ŀ�������2min��5min�Թ�2���������������Ϊ�� �� �����г�����ʽ��������������3λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����������в���ȷ���ǣ� ��
A.NH4HSO4��Һ������Ũ�ȴ�С��ϵ��c��H+����c��SO ![]() ����c��NH
����c��NH ![]() ����c��OH����
����c��OH����
B.�����pH=a�Ĵ�����pH=b��NaOH��Һǡ���кͣ���a+b=14
C.Na2C2O4��Һ�У�c��OH����=c��H+��+c��HC2O4����+2c��H2C2O4��
D.NaHCO3��Һ�У�c��Na+��+c��H+��=c��HCO ![]() ��+2c��CO
��+2c��CO ![]() ��+c��OH����
��+c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���X�ķ���ʽΪC4H8O2 ��X��������������ˮ��Ӧ�����������л���Y��Z��Y��ͭ���±�����ΪW��W�ܷ���������Ӧ.
��1��X��������������_____________________________(������)��
��2��д�����������X�Ľṹ��ʽ_________________________________________��
��3����Y��Z������ͬ��̼ԭ������д�����з�Ӧ�Ļ�ѧ����ʽ:Y��Ũ����Ļ���ﹲ�ȷ�����ȥ��Ӧ____________________________________��W������Cu(OH)2��Ӧ�Ļ�ѧ����ʽΪ_______________________________________________________________��
��4��X��ij��ͬ���칹������ʹʯ����Һ���ɫ����__________________________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȣ�Sr����þ��ͬ����Ԫ�أ��ȵĵ��ʼ��仯������;�㷺�������������������Ͻ𡢹��ܡ������ƣ�Sr��OH��2����ĥ��ʯ���ᴿ��Sr��NO3��2�����̻�װ�ã�SrCl2���������ݵȣ�
��1���ȣ�Sr��λ�����ڱ��ĵ����ڣ����壬�������ȣ�SrO2������Ԫ�صĻ��ϼ�Ϊ ��
��2���������ڳ����º�ˮ��Ӧ�����������ɣ�д���÷�Ӧ�Ļ�ѧ����ʽ
��3�������Ⱥܻ��ã��ڿ������ױ��������ɱ������У�����ţ���ˮ�ھƾ���ú��
��4���ȵ�����������ƣ���֪��CaCl2������ˮ��CaF2������ˮ����д�������Ⱥͷ����Ʒ�Ӧ�����ӷ���ʽ ��
��5�������������±���SrSO4��C�۵Ļ�����2molSrSO4��ȫ��Ӧ��ֻ��S����ԭ��ת��16mol���ӣ�ͬʱֻ����һ�ֿ�ȼ�����壮�÷�Ӧ�Ļ�ѧ����ʽ�� ��
��6����t��ʱ��ijSr��OH��2��ϡ��Һ��c��H+��=10��amolL��1 c��OH����=10��bmolL��1 �� ��֪a+b=12�������Һ����μ���pH=X�����ᣬ��û����Һ�IJ���pH�����ʾ��
��� | Sr��OH��2��Һ�����/mL | ��������/mL | ��Һ��pH |
�� | |||
�� | 22.00 | 18.00 | 7 |
�� | 22.00 | 22.00 | 6 |
��������Һ���ǰ�������仯����XΪ����������գ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����пƬ��ͭƬ��200 mLϡH2SO4��ɵ�ԭ�����ͼ��ʾ��

��1��ԭ��صĸ�����Ӧ��_____________��������Ӧ��________________��
��2�������ķ�����_______________��
��3��һ��ʱ�����ͭƬ�Ϸų�1.68 L����״����������ʱ��H2SO4ǡ������һ�롣�������Щ�����ͬʱ��������_________gп����_________������ͨ���˵��ߣ�ԭ��������ʵ���Ũ����_________������Һ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ӧ��
��A��NaOH+HCl=NaCl+H2O
��B��Cu+2Ag+=2Ag+Cu2+

��1����������Ӧ���ʣ��ж��ܷ���Ƴ�ԭ���________________________________________��
��2��������ܣ�˵����ԭ��_______________________________________________________________��
��3��������ԣ���д�������������ϼ���缫��Ӧʽ�ͷ�Ӧ��������������Ӧ��������ԭ��Ӧ����
������___________��__________________________��__________��
������___________��__________________________��___________��
��������ת�Ƶ���1mol,��������������_________g,�������Һ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӳ�����������������ȣ������ڱ���ǰ18��Ԫ�أ�����������ϵ��Ԫ�ع���( )
A. 1�� B. 2�� C. 3�� D. 4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��̽��Ũ��ϡ���������Ե����ǿ��������ͼװ�ý���ʵ�飨�г���������ȥ����ʵ�����Ũ�����ܽ�NO������NO2 �� ��ϡ���������NO���ɴ˵ó��Ľ�����Ũ�����������ǿ��ϡ���ᣮ��ѡҩƷ��Ũ���ᡢ3mo/Lϡ���ᡢ����ˮ��Ũ���ᡢ����������Һ��CO2 ��
��֪����������Һ����NO��Ӧ������NO2��Ӧ��2NO2+2NaOH=NaNO3+NaNO2+H2O��
��1��ʵ��Ӧ�����к������ŷŵ������У�װ�âۡ��ܡ�����ʢ�ŵ�ҩƷ���������� ��
��2���μ�Ũ����֮ǰ������ɼУ�ͨ��һ��ʱ���CO2 �� ��Ŀ���� ��
��3��װ�â��з�����Ӧ�����ӷ���ʽ�� ��
��4��װ�âڵ������� �� ������Ӧ�Ļ�ѧ����ʽ�� ��
��5����С��ó��Ľ������ݵ�ʵ��������
��6��ʵ�������ͬѧ�Ƿ���װ�â�����Һ����ɫ����������ɫ����ͬѧ��Ϊ�Ǹ���Һ������ͭ�����������ϸ����£�����ͬѧ��Ϊ�Ǹ���Һ���ܽ������ɵ����壮ͬѧ�Ƿֱ����������4���������ж����ֿ����Ƿ���ȷ����Щ�����п��е��� �� ���ɶ�ѡ��a�����ȸ���ɫ��Һ���۲���ɫ�仯
b����ˮϡ����ɫ��Һ���۲���ɫ�仯
c�������ɫ��Һ��ͨ���������۲���ɫ�仯
d��������ͭ��Һ��ͨ��Ũ������ͭ��Ӧ���������壬�۲���ɫ�仯��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com