
【题目】(1)现有下列7种有机物:
①CH4 ②CH3C≡CCH3 ③ ④
④ ⑤
⑤ ⑥
⑥![]() ⑦
⑦
请回答:
其中属于醇类的是___(填序号,下同),互为同系物的是___,能与金属钠反应的有___,互为同分异构体的是___。
(2)肉桂酸甲酯由C、H、O三种元素组成,已知其相对分子质量为162,核磁共振氢谱显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3,利用红外光谱仪检测其中的某些基团,测得红外光谱如图,则肉桂酸甲酯的结构简式是___(不考虑立体异构)。

(3)碳原子数不大于10的烷烃中一氯代物只有一种结构的物质有___种。
【答案】⑦ ①④ ⑥⑦ ③⑤ ![]() 4
4
【解析】
(1)官能团羟基与链烃基或者苯环侧链的碳原子相连形成的化合物属于醇类;结构相似,组成相差n个CH2原子团的有机物为同系物;能与钠反应,有机物含有羟基或羧基等;分子式相同,结构不同的为同分异构体;
(2)根据红外光谱可知肉桂酸甲酯分子中含有双键和酯基,苯环,则其相对分子质量是162,确定分子式,核磁共振氢谱图中有六个吸收峰,峰面积比为1:2:2:1:1:3,说明有6种氢,最后确定结构简式;
(3)烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子。
(1)⑥羟基和苯环直接相连,属于酚类,⑦中羟基和侧链相连,属于醇类;①④结构相似,都为烷烃,相差3个CH2,属于同系物;⑥⑦含有羟基,可与钠反应;③⑤分子式相同,双键的位置不同,属于同分异构体,则其中属于醇类的是⑦,互为同系物的是①④,能与金属钠反应的有⑥⑦,互为同分异构体的是③⑤;
(2)红外光谱可知肉桂酸甲酯分子中含有双键和酯基,苯环,则其相对分子质量是162,确定分子式为C10H10O2,核磁共振氢谱图中有六个吸收峰,峰面积比为1:2:2:1:1:3,说明有6种氢,其结构简式为:![]() ;
;
(3)在碳原子数n≤10的所有烷烃的同分异构体中,其一氯取代物只有一种的烷烃分别是:甲烷、乙烷、2,2-二甲基丙烷以及2,2,3,3-四甲基丁烷,共4种。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y(g)![]() 2W(g)+M(g) △H=-akJ·mol-1(a>0)一定温度下,在体积恒定的密闭容器中,加入1molX(g)与3molY(g),下列说法正确的是( )
2W(g)+M(g) △H=-akJ·mol-1(a>0)一定温度下,在体积恒定的密闭容器中,加入1molX(g)与3molY(g),下列说法正确的是( )
A.充分反应后,放出热量为akJ
B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1∶2
C.当体系的压强不再改变时,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图,关于乙醇在各种反应中断裂键的说法不正确的是( )

A. 乙醇和钠反应,键①断裂
B. 在Ag催化下和O2反应,键①③断裂
C. 乙醇和浓H2SO4共热140℃时,键①或键②断裂;在170℃时,键②⑤断裂
D. 乙醇完全燃烧时断裂键①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,体积一定的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应达到平衡时,X的转化率为50%
D.反应起始时和达平衡时的压强比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华为研发人员利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1﹣xCoO2C6+LiCoO2,其主要优势在于使用寿命长和充电速度快,其工作原理如图所示。下列关于该电池的说法错误的是( )

A.该电池若用隔膜,可选用阳离子交换膜
B.充电时,阴极反应为C6+xLi++xe﹣=LixC6
C.放电时,LiCoO2极发生的电极反应为:LiCoO2﹣xe﹣=Li1﹣xCoO2+xLi+
D.废旧的该电池进行“放电处理”,让Li+嵌入 LiCoO2中有利于回收石墨烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是
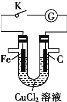
A.打开K,铁棒上有紫红色物质析出
B.闭合K,碳棒上有紫红色固体析出
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。

(1)在元素周期表中全部是金属元素的区域为____________(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________,写出其中含有非极性共价键的化合物的电子式_______________。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①写出甲元素周期表中对应的位置__________。
②甲、乙两元素中,金属性较强的是__________(填元素名称),可以验证该结论的实验是_______________(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+价电子排布式为___________;[Cu(NH3)4]SO4·H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为___________。
(2)SO42-中S原子轨道杂化类型为___________,H3O+几何构型为___________。
(3)NH3极易溶于H2O中,可能的原因为___________。
(4)N、O、S第一电离能由大到小的顺序为___________。

(5)Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag·cm-3,则Cu与F最近距离为___________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有0.1mol·L1的四种溶液:①CH3COOH②NH3·H2O③HCl④FeCl3
(1)用化学用语解释②呈碱性的原因:______。
(2)溶液③的pH=______。
(3)加热、蒸干、灼烧④后所得的产物是______。
(4)25℃时,向20mL①中不断滴入0.1mol·L1的NaOH溶液,混合溶液pH变化如图所示:
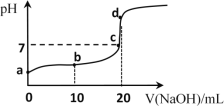
①a点水电离出的c(H+)______10-7mol·L1(填“大于”“小于”或“等于”)
②b点发生反应的离子方程式是______。
③c点溶液中存在的离子的浓度大小关系是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com