
【题目】已知硫酸、氨水的密度与所加水量的关系如下图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
(1)ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
(2)表中2 mol·L-1氨水的质量分数为:________。
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,所得溶液呈______性(填“酸”、“碱”、“中”);溶液中离子浓度从大到小的顺序是:___________________。
(4)将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______。
A.>15% B.=15% C.<15% D.无法判断
(5)100g浓度为4 mol·L-1的硫酸溶液与_____mL水混合,可以使硫酸的物质的量浓度减小到2 mol·L-1。
【答案】 ρ1>ρ2>ρ4>ρ3 (3.4/ρ4)% 酸 c(NH4+)>c(SO42-)>c(H+)>c(OH-) A (200ρ2-100ρ1)/ ρ1
【解析】(1)硫酸的密度大于水的密度,氨水的密度小于水的密度,所以ρ1、ρ2>ρ4、ρ3,硫酸的密度大于水的密度,浓度越大,密度越大,ρ1>ρ2氨水的密度小于水的密度,浓度越大,密度越小,ρ4>ρ3,故答案为:ρ1>ρ2>ρ4>ρ3;
(2)表中2molL-1氨水的密度是ρ4,根据公式c=![]() 得出质量分数为:w=
得出质量分数为:w=![]() %,故答案为:
%,故答案为: ![]() %;
%;
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,恰好反应生成(NH4)2SO4,水解后溶液显酸性;溶液中离子浓度从大到小的顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-),故答案为:酸;c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(4)硫酸的密度大于水的密度,将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数>![]() ,即混合后质量分数大于15%,故答案为:A;
,即混合后质量分数大于15%,故答案为:A;
(5)100g浓度为4molL-1的硫酸溶液中溶质的物质的量是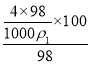 =
=![]() ,设加入水的体积是VmL,能使硫酸的物质的量浓度减小到2molL-1,则2(
,设加入水的体积是VmL,能使硫酸的物质的量浓度减小到2molL-1,则2(![]() )=
)=![]() ,解得V=
,解得V=![]() mL,故答案为:
mL,故答案为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】含有相同质子数和电子数的两种微粒之间的关系不正确的是:
A. 它们可能是同位素 B. 可能是不同的分子
C. 可能是不同的离子 D. 可能是一种分子和一种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
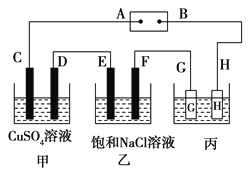
(1)电极A是__________________(填“正极”或“负极”)。
(2)甲装置中电解反应的总化学方程式是_______________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH=__________________。
(4)欲用丙装置给铜镀银。G应该是___(填“银”或“铜”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是
A. 砹易溶于某些有机溶剂 B. 砹化氢很稳定不易分解
C. 砹是有色气体 D. 砹化银不溶于水或稀HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请完成下列问题.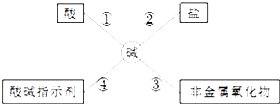
(1)氢氧化钠具有强烈的 , 使用时必须十分小心,实验时最好戴防护眼镜.
(2)为了验证④,小丽将紫色石蕊溶液分别滴入氢氧化钠溶液和澄清石灰水中,溶液变成蓝色,原因是它们在水溶液中能电离出 .
(3)依据反应③什么氢氧化钠必须密封保存否则在空气中要变质;反应的化学方程式为 . 要检验该氢氧化钠溶液已变质,可以选用的试剂是 . (写出化学式)
(4)依据反应②,氢氧化钙溶液能与下列物质反应的是(填序号).
A.稀硫酸
B.氯化钠溶液
C.硫酸铜溶液
D.碳酸钠溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
 A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为3X(g)+Y(g) ![]() 2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com