
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A.A的结构简式为![]()
B.反应④的反应试剂和反应条件是浓H2SO4加热
C.①②③的反应类型分别为取代、消去、加成
D.环戊二烯可发生加聚反应
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是

A.用水湿润的pH试纸测量某溶液的pH
B.用量筒量取20 mL0.5000 mol·L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol· L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置除去Cl2中的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)乙炔在Pd表面选择加氢的反应机理如图,其中吸附在Pd表面上的物种用*标注。

上述反应为_____(填“放热”或“吸热”)反应,历程中最小能垒(活化能)为_____kJ/mol,该步骤的化学方程式为_____。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术。原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。

A.用催化剂A前50s平均反应速率v(N2)=2.5×10﹣2 mol/(Ls)
B.体系各物质状态不变时,反应在任何温度下均可自发进行
C.分离出体系中的H2O(g)有利于氮氧化物的脱除
D.用催化剂C达到平衡时,N2产率最小
(3)废气的变废为宝越来越成为人们共同关注的焦点,某化学课外小组查阅资料得知:
2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)![]() N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2) △H1<0
N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2) △H2<0
2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2) △H2<0
请回答下列问题:
①一定温度下,2NO(g)+O2(g)![]() 2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
②研究发现NO转化为NO2的反应速率随温度的升高而减慢,原因是_____。
③已知:N2O4(g)![]() 2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。
2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构式如下:![]() -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )
A.所有原子可能在同一平面上
B.所有原子可能在同一条直线上
C.所有碳原子可能在同一平面上
D.处在同一平面上的原子最多有20个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的____(填字母代号)。
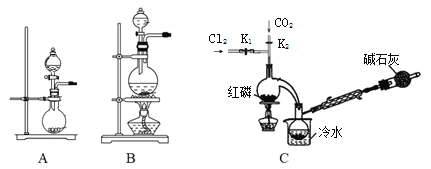
(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是______________。
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
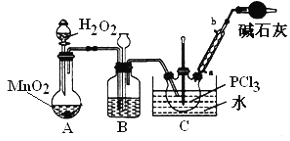
资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ﹣112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(3)POCl3在潮湿空气中会剧烈“发烟”,反应的化学方程式为___________________________________。
(4)反应温度要控制在60~65℃,原因是:_________________________________。
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
b、取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 molL﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe (SO4) 2为指示剂,用0.2 molL﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是__________________________________________。
②产品中Cl元素的质量分数为______________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的有机合成中间体,它的合成路线如图:
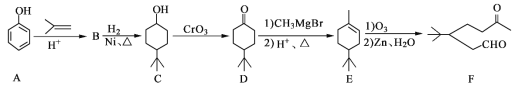
(1)化合物F中含氧官能团的名称是______和______,由A生成B的化学反应类型是______;
(2)写出化合物B的结构简式:______;
(3)写出化合物C与乙酸反应生成酯的化学方程式:______;
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:______(任写一种);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_______。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。
①肼的电子式___________。
②64.0克肼在氧气中完全燃烧生成氮气和液态水放出热量1248kJ(在101kPa,25℃),则表示肼燃烧热的热化学方程式为________________________________________。
(3)工业合成氨的反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
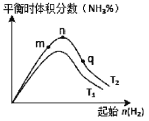
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是__________点。
②图像中T2______T1(填“高于”、“低于”、“等于”或“无法确定”),理由是____________。
③在绝热容器中进行该反应时,压缩容器体积,平衡常数__________(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
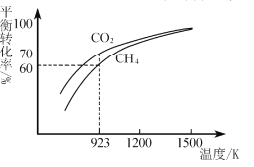
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
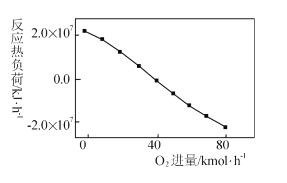
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
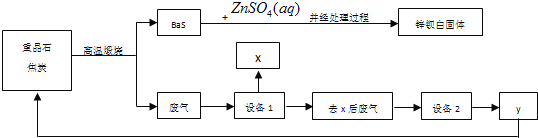
请根据上述流程回答下列问题:
(1)重晶石的化学式为_______,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程![]() 的步骤为:①_________;②洗涤;③______________。
的步骤为:①_________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是__________________________________。
(4)检验锌钡白中含有S2-的方法是________________________________________。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为________。写出设备2中发生反应的离子方程式:___________________________________、_________________________________。
(6)可用_______法分离溶液中的钠盐,进行分离前,需要查得的是______________________。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为___________(至少写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com