
����Ŀ��POCl3�������뵼����Ӽ������άԭ�ϣ�ʵ�����Ʊ�POCl3���ⶨ��Ʒ������ʵ��������£�
I���Ʊ�PCl3
��1��ʵ�����ø�����غ�Ũ���ᷴӦ������������װ�ÿ�����ͼ�е�____������ĸ���ţ���
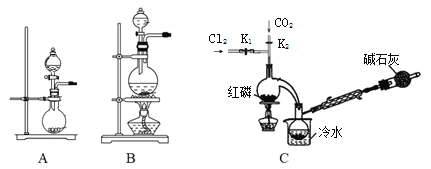
��2�����װ��C�����Բ�װ��ҩƷ���ȹر�K1����K2ͨ������CO2��һ��ʱ��ر�K2����������ƿͬʱ��K1ͨ�������������Ӧ�������С�ͼ�м�ʯ�ҵ�������______________��
II��ʵ�����Ʊ�POCl3��
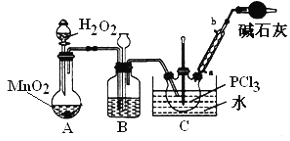
������������Һ̬PCl3����ȡPOCl3��ʵ��װ�ã����ȼ��г������ԣ���ͼ��
���ϣ���Ag++SCN����AgSCN����Ksp��AgCl����Ksp��AgSCN����
��PCl3��POCl3�������Ϣ���±���
���� | �۵�/�� | �е�/�� | ��Է������� | ���� |
PCl3 | ��112.0 | 76.0 | 137.5 | �����ܣ���Ϊ��ɫҺ�壬��ˮ�����ҷ�Ӧ���ɺ�������Ȼ��� |
POCl3 | 2.0 | 106.0 | 153.5 |
��3��POCl3�ڳ�ʪ�����л���ҡ����̡�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
��4����Ӧ�¶�Ҫ������60��65�棬ԭ���ǣ�_________________________________��
��5��ͨ��������·����Բⶨ��Ʒ��ClԪ�غ�����ʵ�鲽�����£�
a��ȷ��ȡ15.0 g POCl3��Ʒ������ʢ��60.00 mL����ˮ��ˮ��ƿ��ҡ������ȫˮ�⣬��ˮ��Һ���100.00 mL��Һ��
b��ȡ10.00 mL��Һ����ƿ�У�����10.00 mL 3.2 molL��1 AgNO3����Һ��
c��������������������ҡ����ʹ�������汻�л��︲�ǡ�
d����NH4Fe (SO4) 2Ϊָʾ������0.2 molL��1 NH4SCN��Һ�ζ�������AgNO3��Һ���ﵽ�ζ��յ�ʱ����ȥl0.00 mL NH4SCN��Һ��
�ٲ���d�дﵽ�ζ��յ��������__________________________________________��
�ڲ�Ʒ��ClԪ�ص���������Ϊ______________������3λ��Ч���֣���
���𰸡�A ����β��������ֹ�����е�ˮ��������������ƿ POCl3+3H2O��H3PO4+3HCl �¶ȹ��ͣ���Ӧ�ٶ�̫�����¶ȹ��ߣ�PCl3�ӷ��������ʵ� ��Һ����ɫ��Ϊ��ɫ��30 s�ڲ��ٱ�ɫ 71.0%
��������
I����1��������غ�Ũ���ᷴӦ�����������ڹ����Һ�巴Ӧ����Ӧ����Ҫ���ȣ��ݴ�ѡ��װ�ã�
��2�����������ж�����ƷPCl3��ˮ�����ҷ�Ӧ���ɺ�������Ȼ�����з�����
II��ʵ�����Ʊ�POCl3��Aװ������˫��ˮ��������̷�Ӧ����������ͨ������˫��ˮ���������Կ��Ʋ������������ʣ������к���ˮ������Ũ�����ȥ������Bװ����װŨ���ᣬװ��B���г���©��������ƽ��װ�������ѹǿ����ȫƿ�����ã����������������Ȼ���Ӧ����POCl3��Ϊ�˿��Ʒ�Ӧ������Ҫ��ֹ���Ȼ��ӷ�����Ӧ���¶ȿ�����60��65��������װ��C����ˮԡ��Ϊ��ֹPOCl3�ӷ����������ܽ�������������POCl3��ˮ������ˮ��Ϊ��������Ȼ��⣬����Ϊ��ֹ������ˮ��������װ�ã�ͬʱ����β����������װ�õ�������м�ʯ�ҵĸ���ܣ��ݴ˷����ش����⡣
I����1�������Һ�巴Ӧ����Ӧ����Ҫ���ȣ��ݴ�ѡ��װ��A��
�𰸣�A��
��2�����������ж������β�������ŷŵ������У���ƷPCl3��ˮ���ҷ�Ӧ��Ҫ��ֹ�����е�ˮ��������������ƿ��
�𰸣�����β��������ֹ�����е�ˮ��������������ƿ��
II����3��POCl3�ڳ�ʪ�����л��������������ȷ����HCl���ɣ�������Ԫ�صĻ��ϼۻ�����ȷ�����������ɣ�����ʽΪPOCl3+3H2O��H3PO4+3HCl��
�𰸣�POCl3+3H2O��H3PO4+3HCl ��
��4����������ķ�����֪����Ӧ�¶�Ӧ������60��65����ԭ�����¶ȹ��ͣ���Ӧ����С���¶ȹ��ߣ����Ȼ���ӷ��������ʵͣ�
�𰸣��¶ȹ��ͣ���Ӧ�ٶ�̫�����¶ȹ��ߣ�PCl3�ӷ��������ʵ� ��
��5����ΪFe3+��SCN-��ϣ���Һ���죬�����NH4Fe (SO4) 2Ϊָʾ������0.2 molL��1 NH4SCN��Һ�ζ�������AgNO3��Һ���ﵽ�ζ��յ����������Һ����ɫ��Ϊ��ɫ��30 s�ڲ��ٱ�ɫ��
�𰸣���Һ����ɫ��Ϊ��ɫ��30 s�ڲ��ٱ�ɫ��
��6���ⶨPOCl3��Ʒ��������POCl3��ˮ��Ӧ�����Ȼ��⣬Ȼ��������������Һ������Һ�е������ӣ�NH4SCN��Һ�ζ�������AgNO3��Һ������NH4SCN�����ʵ����ɼ������Һ��ʣ���AgNO3�����AgNO3�������ʵ�����֪�������ӷ�Ӧ���������������������Һ�������ӵ����ʵ���������ȷ����Ԫ�ص�����������NH4SCN�����ʵ���Ϊ0.2mol/L��0.01L=0.002mol�����ݷ�ӦAg++SCN-=AgSCN������֪��Һ��ʣ��������ӵ����ʵ���Ϊ0.002mol��POCl3��ˮ��Ӧ�����Ȼ�������ʵ���Ϊ��3.2��0.01mol-0.002mol����10=0.3mol����Ԫ�ص���������Ϊ![]() ��100%=71.0%��
��100%=71.0%��
�𰸣�71.0%��


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���綯���������ȼ�������ǽ��ܼ��š�������������Ҫ�ٴ�֮һ����ͼ��ʾ�����һ�����ڿ����ij��ص�ء��йظõ�ص�˵����ȷ����
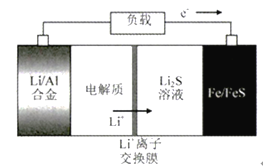
A. �ŵ�ʱFe/FeS���Ǹ���
B. �ŵ�ʱ������ӦʽΪ��Al-3e-=Al3+
C. ���ʱ������ӦʽΪ��Fe+S2--2e-=FeS
D. ��ߵ���ʿ�����LiOH�Ĵ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.W��X��Y��Z��ԭ���������������ͬһ������Ԫ�أ�W��X�ǽ���Ԫ�أ�Y��Z�Ƿǽ���Ԫ�ء�
��1��W��X������������Ӧ��ˮ������Է�Ӧ�����κ�ˮ���÷�Ӧ�����ӷ���ʽΪ_______________________________________________��
��2��W��Y���γɻ�����W2Y���û�����ĵ���ʽΪ_______________��
II.A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʡ�
����֮�������µķ�Ӧ��ϵ��
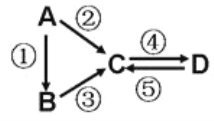
��3����A�ǵ���ɫ���ʹ��壬C��D���������C������������Ҫ���ʡ���C����һ�ֵ���ɫ���ʷ�Ӧ�Ļ�ѧ����ʽ______________________________________��
��4����D���ʾ������ԣ��ڢ۷�Ӧ��Ҫ��ǿ����Һ���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���塣�жϵ���A��Ԫ�������ڱ��е�λ����________________��
��5����A��Ӧ����㷺�Ľ������ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ַǽ������ʡ�C����Һ����ʴ��ӡˢͭ��·�壬д�÷�Ӧ�����ӷ���ʽ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ӳ֬�������������Ȼ��֬�ijɷ֡� ���ǵĽṹ��ʽ����ͼ��ʾ��
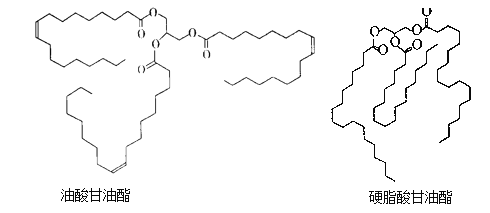
����˵���������
A. ����ķ���ʽΪC18H34O2
B. Ӳ֬���������һ�ȴ��ﹲ��54��
C. ��Ȼ��֬������NaOH��Һ�з���ȡ����Ӧ
D. ������������⻯ΪӲ֬����������ӳ�����ʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��11.0 g�������Ͻ𣬼���һ������ϡ�����Ͻ���ȫ�ܽ⣬Ȼ���H2O2����Һ����Fe2+���ڣ����ȳ�ȥ�����H2O2��������200 mL 6 molL��1NaOH��Һʱ��������࣬�����ó�������Ϊ26.3 g������˵������ȷ����
A.�úϽ�����������Ϊ5.6 g
B.�Ͻ���ϡ���ᷴӦ������0.45 mol H2
C.�úϽ��������������Ʒ�Ӧ��ת�Ƶĵ�����Ϊ0.6 NA
D.���ӵ�ϡ�����к�0.6 mol H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ���ǣ� ��
A. 17 g�ǻ�(��OH)�����еĵ�������10NA��
B. 1 mol����ϩ�к��е�̼̼˫����Ϊ4NA��
C. �����£�14 g��ϩ�ͱ�ϩ�Ļ��������ԭ����Ϊ3NA��
D. 4.2 g C3H6�к��е�̼̼˫����һ��Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ���л���X������S���տ���Y������˵����ȷ���ǣ� ��
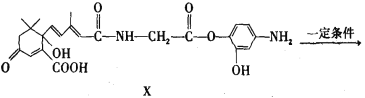
A. X���Է���������ȡ�����������Ӿۡ����۷�Ӧ�����������ᷴӦ�����л���
B. Y�ȿ�����FeCl3��Һ������ɫ��Ӧ���ֿ�ʹ����KMnO4��Һ��ɫ
C. 1mol X������NaOH��Һ��Ӧ���������4mol NaOH
D. �л����������ijһ��̼ԭ������4����ͬ��ԭ�ӻ���ţ�����̼ԭ�ӳ�Ϊ������̼ԭ�ӡ�������X�ṹ����2������̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��ԭ���������������ͬһ������Ԫ�أ�W��X�ǽ���Ԫ�أ�Y��Z�Ƿǽ���Ԫ�ء�
��1��W��X������������ˮ����֮��������Ӧ���κ�ˮ���÷�Ӧ�����ӷ���ʽΪ___��
��2��W��Y���γɻ�����W2Y���û�����ĵ���ʽΪ___��
��3���Ƚ�Y��Z��̬�⻯����ȶ��� �� ���û�ѧʽ��ʾ��___��
��4��Y�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ___��
��5��W��X��Y��Z����Ԫ�ؼ����ӵ����Ӱ뾶�ɴ�С��˳���ǣ� �� �� �� �������ӷ��ű�ʾ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
(1)�� 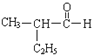 ϵͳ����Ϊ______����������Һ��Ӧ�Ļ�ѧ����ʽΪ__________
ϵͳ����Ϊ______����������Һ��Ӧ�Ļ�ѧ����ʽΪ__________
��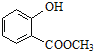 �к��еĹ����ŵ�����Ϊ_____��
�к��еĹ����ŵ�����Ϊ_____��
(2)�����_____�ֽṹ����д�����еĺ˴Ź��������ж������շ�Ľṹ��ʽ______��
(3)���ࡢ��֬�������ʶ�����������Ӫ�����ʡ����������Т������Ǣ���ѿ�Ǣ����Ǣ���ά�آݵ��ۣ���Ϊͬ���칹�����___�����л�ԭ�ԣ��ܷ���������Ӧ����___��������ţ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com