
【题目】氰化氢是剧毒物质,含有氰的废水对环境的污染和人体的危害非常严重。
(1)氢氰酸(HCN)的电子式为______。
(2)用电解的方法可以除去含有CN-、Cl-废水中的CN-,其原理是控制溶液pH为9-10,利用阳极产生的ClO-将CN-氧化为两种无污染的气体。
①阳极的电极反应式:_________。
②除去CN-的离子方程式为:_________。
(3)已知25℃时,HCN的电离常数Ka=4.9×10-10,则25℃时0.1mol/L 的HCN溶液中c(H+)=_____mol/L。NaCN溶液中加入盐酸至恰好完全反应,溶液中所有离子浓度的关系为___________。
【答案】 ![]() Cl--2e-+2OH-=C1O-+H2O H2O+5C1O-+2CN-=2CO2+N2+5Cl-+2OH- 7×10-6 c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-)
Cl--2e-+2OH-=C1O-+H2O H2O+5C1O-+2CN-=2CO2+N2+5Cl-+2OH- 7×10-6 c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-)
【解析】 (1)氢氰酸(HCN)的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)用电解的方法可以除去含有CN-、C1-废水中的CN-,其原理是控制溶液PH为9~10,利用阳极产生的C1O-将CN-氧化为两种无污染的气体。
①该电解质溶液呈碱性,电解时,用不活泼金属或导电非金属作负极,可以用较不活泼金属作正极,石墨做阳极,阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故答案为:Cl--2e-+2OH-=C1O-+H2O;
②阳极产生的ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故答案为:H2O+5C1O-+2CN-=2CO2+N2+5Cl-+2OH-;
(3) 根据HCN![]() H++CN-可知,Ka=
H++CN-可知,Ka=![]() =
=![]() =
=![]() =4.9×10-10,c(H+)= 7×10-6;NaCN溶液中加入盐酸至怡好完全反应生成等物质的量的氯化钠和HCN,溶液显酸性,溶液中所有离子浓度的关系为c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-),故答案为:7×10-6;c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-)。
=4.9×10-10,c(H+)= 7×10-6;NaCN溶液中加入盐酸至怡好完全反应生成等物质的量的氯化钠和HCN,溶液显酸性,溶液中所有离子浓度的关系为c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-),故答案为:7×10-6;c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有机物分子中,所有原子不可能处于同一平面的是( )
A. CH2=CH—CN B. CH2=CH—C(CH3)=CH2
C. ![]() D. CH2=CH—CH=CH2
D. CH2=CH—CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应又属于氧化还原反应且反应过程中会放出热量的是( )
A. 甲烷在氧气中的燃烧反应 B. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
C. 灼热的碳与二氧化碳的反应 D. 钠与水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空:
(1)碱金属元素原子最外层的电子都是________个,在化学反应中它们容易失去________个电子。
(2)碱金属元素中还原性最强的是________,原子半径最小的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于CH3—CH=CH—C≡C—CF3分子结构的叙述中,正确的是
A.6个碳原子有可能都在一条直线上B.6个碳原子可能都在一条直线上
C.6个碳原子一定都在同一平面上D.6个碳原子不可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:

硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)有机物A、B、C、D、E之间发生如下的转化:
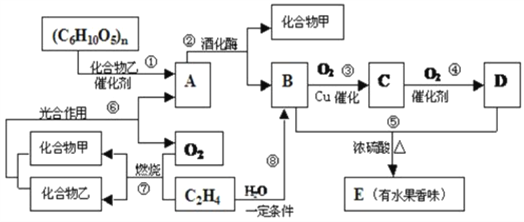
(1)写出C物质的结构简式:_________________;
(2)上述②~⑧转化反应中,属于取代反应的有____________;属于加成反应的有_______________________(用反应序号填写);
(3)向A的水溶液中加入新制的Cu(OH)2并加热时产生的实验现象是__________________________________________________________;
请写出下列转化的化学反应方程式:
(4)B + D → E:_______________________________________________;
(5)乙烯生成聚乙烯:__________________________________________;
(Ⅱ)己知葡萄糖在乳酸菌的作用下转化为乳酸,乳酸的结构简式为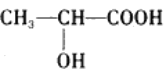 。
。
试回答:
(6)乳酸分子中含有________________和_______________两种官能团(写名称);
(7)乳酸与金属钠反应的化学方程式为_________________________________;
(8)足量乳酸与Na2CO3溶液反应的化学方程式为______________________________;
(9)乳酸在浓硫酸作用下,两分子相互发生酯化反应生成环状酯,此环状酯的结构简式为 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:
NH3+H3BO3=NH3·H3BO3;
NH3·H3BO3+HCl= NH4Cl+ H3BO3。

回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水:打开k1,关闭k2、k3,加热b,蒸气充满管路:停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水,打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com