
【题目】填空:
(1)碱金属元素原子最外层的电子都是________个,在化学反应中它们容易失去________个电子。
(2)碱金属元素中还原性最强的是________,原子半径最小的是________。
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
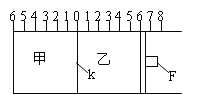
(1)可根据__________现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是____________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为_____mol,乙中C的转化率________50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度________处(填下列序号:① <6 ② >6 ③ =6)
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为_________;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述正确的是
A.标准状况下,2.24LCCl4中含有0.4NA个碳氯单键
B.22.4LCl2通入水中充分反应,共转移NA个电子
C.1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA
D.5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%,密度为1.84 g·cm-3的浓硫酸配制1 mol/L稀硫酸100 mL,其操作有以下各步:
①用量筒量取一定体积的浓硫酸
②洗涤烧杯和玻璃棒2~3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸转入容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2 cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取__________mL浓硫酸;应选择_________mL量筒(填5、10 或 50)。
(2)本实验用到的仪器己有烧杯、量筒、玻璃棒,还缺少的仪器是___________。
(3)正确的操作顺序是_________________(用序号填写)。
(4)下列操作会对所配溶液浓度产生什么影响(填“偏高”、“偏低”或“无影响”)
①转移浓硫酸后,小烧杯未洗涤:_______________;
②量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中:________________;
③定容时俯视容量瓶刻度线:________________;
④使用前容量瓶未干燥:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体。请回答下列问题:

(1)A、G的化学式分别为_______________、________________。
(2)写出A与Fe反应的化学方程式___________________ 。
(3)写出反应②的化学方程式______________________。
(4)己知A是一种重要的化工原料,在工农业生产和生活中有着重要的应用。请根据所学知识回答下列问题。
①将A通入紫色石蕊试液中,观察到的现象是________________;请写出A与水反应的化学方程
式 。
②A与石灰乳反应制得的漂白粉的有效成分是_________(填化学式);该物质在空气中失效的原因______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气是一种大气污染状态,是对大气中各种悬浮颗粒物含量超标的笼统表述,尤其是PM2.5(空气动力学当量直径小于等于2.5微米的颗粒物)被认为是造成雾霾天气的“元凶”。雾霾的化学成分较为复杂,包含有下列物质,其中属于有机化合物的是( )
A. 臭氧 B. 碳氢化合物 C. 氮氧化物 D. 一氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化氢是剧毒物质,含有氰的废水对环境的污染和人体的危害非常严重。
(1)氢氰酸(HCN)的电子式为______。
(2)用电解的方法可以除去含有CN-、Cl-废水中的CN-,其原理是控制溶液pH为9-10,利用阳极产生的ClO-将CN-氧化为两种无污染的气体。
①阳极的电极反应式:_________。
②除去CN-的离子方程式为:_________。
(3)已知25℃时,HCN的电离常数Ka=4.9×10-10,则25℃时0.1mol/L 的HCN溶液中c(H+)=_____mol/L。NaCN溶液中加入盐酸至恰好完全反应,溶液中所有离子浓度的关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蛋白质分子由N条肽链组成,已知它共由M个氨基酸组成,则此蛋白质中至少含有的氧原子数有( )
A. 2M个 B. (M-N)个 C. M个 D. (M+N)个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com