
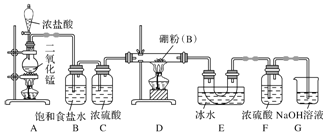
分析 A装置制备氯气,制备的氯气中含有HCl、水蒸气,B装置吸收HCl,C装置干燥氯气,D装置中氯气与硼反应生成BCl3,E装置冷却和收集三氯化硼,三氯化硼遇水水解,F装置防止水蒸气加入E中,氯气有毒,直接排放会污染空气,G装置吸收氯气,据此分析作答.
解答 解:A装置制备氯气,制备的氯气中含有HCl、水蒸气,B装置吸收HCl,C装置干燥氯气,D装置中氯气与硼反应生成BCl3,E装置冷却和收集三氯化硼,三氯化硼遇水水解,F装置防止水蒸气加入E中,氯气有毒,直接排放会污染空气,G装置吸收氯气.
(1)由仪器结构可知盛装浓盐酸的仪器为分液漏斗;
故答案为:分液漏斗;
(2)E中冰水冷却便于收集三氯化硼;
故答案为:冷却和收集三氯化硼;
(3)D中氯气与硼在加热条件下生成三氯化硼,反应方程式为:2B+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3;
故答案为:2B+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3;
(4)由于三氯化硼遇水水解,F装置防止水蒸气加入装置E中,可以用一个盛装碱石灰的干燥管代替装置F和G;
故答案为:防止水蒸气进入装置E;碱石灰;
(5)根据题中信息可知:硼能与氧气反应,故应先通氯气排除装置中的空气,防止硼与空气中的氧气反应,所以在加热制备三氯化硼,故先点燃A处酒精灯,后点燃D处酒精灯;
故答案为:A;先用Cl2排尽装置中的空气,避免氧气和硼粉反应.
点评 本题考查物质制备实验,侧重于学生的分析能力和实验能力的考查,题目涉及制备气体、净化气体、干燥气体和尾气处理,明确原理是解题关键,注意题目信息的应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体中分散质粒子的直径大于溶液中分散质的粒子直径 | |
| B. | 向饱和的氯化铁溶液中加入氢氧化钠溶液得到红褐色沉淀 | |
| C. | 明矾【KAl(SO4)2•12H2O】可以做净水剂 | |
| D. | 氢氧化铁溶胶、稀豆浆、云雾等均具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如右图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如右图实验装置.依据实验设计,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:K+、Fe3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、[Al(OH)4]-、CO32- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol/L的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24LCO2中含0.3NA原子 | |
| B. | 0.3molNH4NO3固体中含0.3NANH4+ | |
| C. | 5.6g铁粉完全反应一定失去0.3NA电子 | |
| D. | 25℃,0.1NAHCl气体溶于1L水,溶液pH=1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com