
分析 (1)石灰石、二氧化硫、氧气和水反应生成生石膏的反应为2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g),根据盖斯定律,该反应等于①×2+②×2+③,计算△H;
(2)氮氧化物与氨气发生的反应是氧化还原反应,氮氧化物把氨气氧化为氮气,本身被还原为氮气,可以利用反应方程式通过设未知列方程组计算;也可以根据氧化还原反应的电子守恒计算;也可以利用平均值法计算;
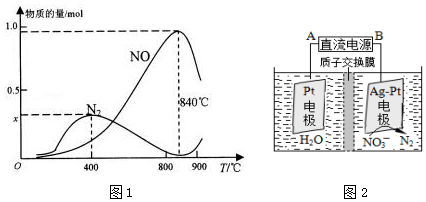
(3)①在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,结合氮元素守恒计算x;
②氨气和氧气的反应为放热反应,温度高于840℃后,各物质的物质的量发生变化,NO减小,氮气增加,结合化学平衡影响因素分析判断;
(4)阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有水生成;转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室.
解答 解:(1)石灰石、二氧化硫、氧气和水反应生成生石膏的反应为2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g),根据盖斯定律,该反应等于①×2+②×2+③,计算△H=+178.2×2+(-402)×2+(-234.2)=-681.8kJ/mol,
故答案为:2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol;
(2)根据反应可知:氨气被氧化为氮气,NH3~N2~3e-;一氧化氮被还原为氮气,NO~N2~2e-二氧化氮被还原为氮气NO2~N2~4e-
设一氧化氮体积为x,二氧化氮体积为3-x,氨气的体积为3.5L,根据电子守恒可知:3.5L×3=2x+4×(3-x),x=0.75L,二氧化氮体积为2.25L,则相同条件下,混合气体中NO和NO2的体积比等于物质的量之比=0.75:2.25=1:3;
故答案为:1:3;
(3)①在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,结合氮元素守恒计算,5y+6y×2+3y=1
y=0.05
氮气物质的量=6y=0.05mol×6=0.3mol,
x=0.3
故答案为:0.3;
②上述计算分析可知,NH3生成NO和N2的反应分别属于放热反应,温度高于840℃后,各物质的物质的量发生如图所示变化,NO减小,N2物质的量增大,可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水,
故答案为:放热反应;可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水;
(4)在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O生成,所以阴极上发生的电极反应式为:2NO3-+12 H++10e-=N2↑+6H2O,转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,
故答案为:2NO3-+12 H++10e-=N2↑+6H2O;14.4.
点评 本题考查电解原理、电极反应式书写、电解计算等知识点,要注意该题中阴极室有氢离子进入,易漏掉,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
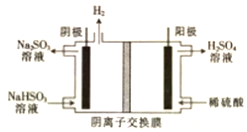 电解原理在工业生产中应用广泛.
电解原理在工业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
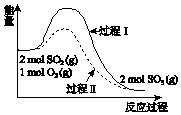 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应能量变化如图所示.下列说法中,不正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应能量变化如图所示.下列说法中,不正确的是( )| A. | a<0 | |
| B. | 过程II可能使用了催化剂 | |
| C. | 使用催化剂可以提高SO2的平衡转化率 | |
| D. | 反应物断键吸收能量之和小于生成物成键释放能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A、C两点对应溶液均呈中性 | |
| C. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-) | |
| D. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
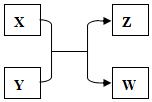 X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件).
X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com