
����Ŀ�������Ԫ�����ڱ���һ���֣����ݱ��еĢ١�����Ԫ�أ�����صĻ�ѧ������գ�
IA | 0 | |||||||
1 | �� | IIA | IIIA | IVA | VA | VIA | ��A | |
2 | �� | �� | �� | �� | �� | |||
3 | �� | �� | �� | �� | ||||
��1��Ԫ�آ�������� �� ��Ԫ��ԭ�ӵ�ʧ���ӵĽǶȿ���Ԫ�آܾ�����������ԡ�������ԭ�ԡ�������Ԫ�آ���������16��Ԫ�������ڱ�������λ����
��2���ޢܢߵ��⻯���ȶ���������ǿ��˳�����Σ���д�⻯��Ļ�ѧʽ����
��3��Ԫ�آ۵���̬�⻯����������������ˮ���ﷴӦ�ķ���ʽΪ��
��4��д��Ԫ�آ��γɵĵ�����������ȼ�ղ���ĵ���ʽ �� ��һ��Ӧ��������ȡ��������ȡ�����Ӧ��Ԫ�آں͢��γɻ��������ʽΪ��
��5���õ���ʽ��ʾ����ᷴӦ�õ��Ļ�������γɹ�����
��6��ijԪ��R����̬�⻯��ΪHXR����R�ڸ��⻯���е���������Ϊ94%��8.5g��HXR�����ڱ�״̬�µ������5.6L��HXR�Ļ�ѧʽΪ ��
���𰸡�
��1���������ԣ��������ڵڢ�����
��2��SiH4��PH3��H2O
��3��NH3+HNO3=NH4NO3
��4��![]() �����ȣ�
�����ȣ�![]()
��5��![]()
��6��H2S
���������⣺��1��Ԫ�آ����������Oԭ�������6�����ӣ���2�����Ӵﵽ�ȶ��ṹ�����OԪ�ؾ��������ԣ���Ne��������16��Ԫ��ΪFe��λ�ڵ������ڵڢ����壻 ���Դ��ǣ��������ԣ��������ڵڢ����壻��2���ǽ�����Խǿ����̬�⻯���ȶ���Խǿ��Ԫ�طǽ����ԣ�Si��P��O����̬�⻯����ȶ��ԣ�SiH4��PH3��H2O��
���Դ��ǣ�SiH4��PH3��H2O����3��N����̬�⻯���ǰ�����N������������ˮ���������ᣬ���������ᷴӦ��������泥���ѧ����ʽΪ��NH3+HNO3=NH4NO3 ��
���Դ��ǣ�NH3+HNO3=NH4NO3����4��Na��������ȼ�����ɹ������ƣ���������Ϊ���ӻ����������Ϊ���������ӣ��������Ƶĵ���ʽΪ ![]() �����е�ȼ�շ�Ӧ�����ڷ��ȷ�Ӧ��C��O���γɻ����������̼��̼ԭ�ӷֱ���������ԭ���γ������Թ��õ��Ӷԣ�������̼�ĵ���ʽΪ
�����е�ȼ�շ�Ӧ�����ڷ��ȷ�Ӧ��C��O���γɻ����������̼��̼ԭ�ӷֱ���������ԭ���γ������Թ��õ��Ӷԣ�������̼�ĵ���ʽΪ ![]() ��
��
���Դ��ǣ� ![]() �����ȣ�
�����ȣ� ![]() ����5��H��S�γɻ�������H2S��H2S����H��S�Թ��õ��Ӷ��γɵĹ��ۻ�����γɹ���Ϊ
����5��H��S�γɻ�������H2S��H2S����H��S�Թ��õ��Ӷ��γɵĹ��ۻ�����γɹ���Ϊ ![]() ��
��
���Դ��ǣ� ![]() ����6��HxR�����ڱ�״���µ������5.6L��˵�����ʵ���Ϊ5.6/22.4=0.25mol������Ϊ��������Ϊ8.5g������Ħ������Ϊ
����6��HxR�����ڱ�״���µ������5.6L��˵�����ʵ���Ϊ5.6/22.4=0.25mol������Ϊ��������Ϊ8.5g������Ħ������Ϊ ![]() =34�����HxR����Է�������Ϊ34��R�ڸ��⻯���е���������Ϊ94%������R��ԭ����Ϊ34��0.94=32������R��S�����HxR�Ļ�ѧʽΪH2S��
=34�����HxR����Է�������Ϊ34��R�ڸ��⻯���е���������Ϊ94%������R��ԭ����Ϊ34��0.94=32������R��S�����HxR�Ļ�ѧʽΪH2S��
���Դ��ǣ�H2S��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1L 1mol/L KOH��Һ����0.8mol CO2��������Һ��CO32����HCO3�������ʵ���Ũ��֮��Ϊ
A. 1��3 B. 2��1 C. 2��3 D. 3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ������������Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϣ��ᴿ��������ɳ�Ĵ��Σ�һ�㾭�����²������̣� 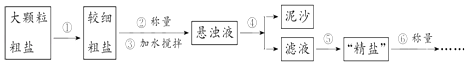
��1���������г��õ�����̨������Ȧ�����ƾ��ơ�������������ǯ�⣬����Ҫ�õ��������� ��
��2��ʵ������������õġ����Ρ��������㡰���Ρ����Ƶ��ʣ������Ƶ��ʽϵͣ������ԭ����������ţ���
A.����û��ȫ���ܽ⼴����
B.����ʱҺ�ηɽ�����
C.���������á����Ρ��ܳ�ʪ
D.��������ճ�еġ����Ρ�û��ȫ��ת�Ƶ�����ֽ��
��3��С������������ϵ�֪�������г�����ɳ�Ȳ����������⣬������������MgCl2��CaCl2�ȿ��������ʣ�Ϊ�˵õ��ϴ������Ȼ��ƣ�С������������ͼ�в����ݵõ��ġ����Ρ����������´������ٶ�����ֻ��MgCl2��CaCl2���֣��� 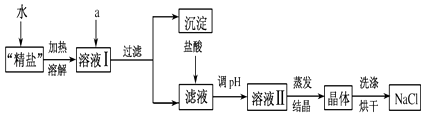
���ṩ���Լ���Na2CO3��Һ��K2CO3��Һ��NaOH��Һ��KOH��Һ������NaCl��Һ��
���ṩ���Լ���ѡ��a���������Լ����� �� д��������Ӧ�����ӷ���ʽ �� ��
������Һ�м�����������������û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ������������Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϣ��ᴿ��������ɳ�Ĵ��Σ�һ�㾭�����²������̣� 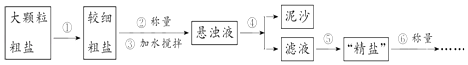
��1���������г��õ�����̨������Ȧ�����ƾ��ơ�������������ǯ�⣬����Ҫ�õ��������� ��
��2��ʵ������������õġ����Ρ��������㡰���Ρ����Ƶ��ʣ������Ƶ��ʽϵͣ������ԭ����������ţ���
A.����û��ȫ���ܽ⼴����
B.����ʱҺ�ηɽ�����
C.���������á����Ρ��ܳ�ʪ
D.��������ճ�еġ����Ρ�û��ȫ��ת�Ƶ�����ֽ��
��3��С������������ϵ�֪�������г�����ɳ�Ȳ����������⣬������������MgCl2��CaCl2�ȿ��������ʣ�Ϊ�˵õ��ϴ������Ȼ��ƣ�С������������ͼ�в����ݵõ��ġ����Ρ����������´������ٶ�����ֻ��MgCl2��CaCl2���֣��� 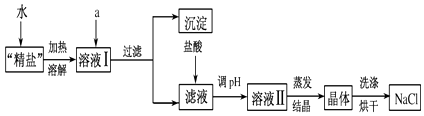
���ṩ���Լ���Na2CO3��Һ��K2CO3��Һ��NaOH��Һ��KOH��Һ������NaCl��Һ��
���ṩ���Լ���ѡ��a���������Լ����� �� д��������Ӧ�����ӷ���ʽ �� ��
������Һ�м�����������������û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽����ȷ����
A. �þƾ���ȡ��ˮ�еĵ�
B. �� NO2 �� NO �������ͨ������ˮ�����ɳ�ȥ��������е� NO2
C. ����������������Ȼ�̼��ˮ
D. Ϊ��ȥ FeCl2 ��Һ�� FeCl3 ������������Һ�м�������ͭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ƿ�ޱ�ǩ����ɫ�ܲ����ֱ�װ��Na2CO3��NaHCO3���������Լ����ܽ��������ֵ���
��Ca(OH)2 �������CaCl2 ��NaOH �ݼ���
A. �ڢ� B. �٢� C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100 mL 0.1 mol/L BaCl2��Һ��BaCl2�����ʵ�����
A. 0.01 mol B. 0.03 mol C. 0.1 mol D. 0.3 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ50.0mLNa2CO3��Na2SO4�Ļ����Һ���������BaCl2��Һ��õ�14.51g��ɫ�������ù���ϡ���ᴦ������������ٵ�4.66g����������ų����Լ��㣺
��1��ԭ���Һ��CO32�������ʵ���Ũ��Ϊ �� Na+�����ʵ���Ũ��Ϊ ��
��2�������������ڱ�״���µ����L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com