
【题目】下列实验方案正确的是
A. 用酒精萃取碘水中的碘
B. 将 NO2 和 NO 混合气体通入足量水中,可除去混合气体中的 NO2
C. 用蒸馏操作分离四氯化碳和水
D. 为除去 FeCl2 溶液的 FeCl3 杂质,可向溶液中加入足量铜粉,过滤
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是( ) 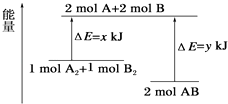
A.该反应是吸热反应
B.断裂1mol A﹣A键和1mol B﹣B键能放出xkJ的能量
C.断裂2mol A﹣B键需要吸收ykJ的能量
D.2mol AB的总能量高于1 mol A2和1mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示的是某同学通过实验得出的H2O2浓度与酶促反应速率关系图,图2是实验过程中的一个装置图.请分析回答下列问题:
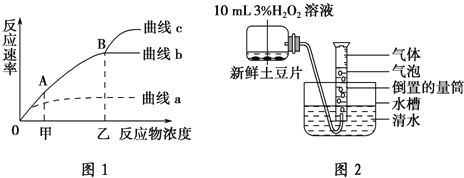
(1)图1中AB段说明反应速率大小主要与 有关,对应图2中的实验装置如何设计 .
(2)如果图2装置中放入的是经高温处理过的土豆片,实验现象是 ,原因是 .
(3)实验过程中温度、pH等保持不变,形成曲线a与曲线b差异的可能原因是 ;将图2装置中含有新鲜土豆片的烧瓶分别放置在不同温度的水浴锅中,定时记录不同温度条件下产生的气体量,绘制出的温度对H2O2酶酶促反应速率影响的曲线图不够科学,其原因是 .
(4)曲线b在B点后反应速率不再增加的原因是 ,曲线C形成的可能原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究30℃条件下pH值对某动物体内两种消化酶活性的影响,结果见下表。回答下列问题:
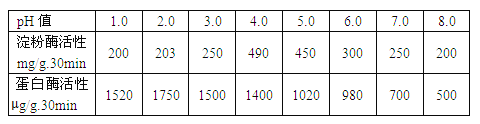
(1)该实验的因变量是______。在实验过程中需要添加缓冲液调节pH值,这是对实验的______变量的控制。若要进一步确定淀粉酶的最适pH值,简要的实验思路是:_______。
(2)消化酶的作用机理是______。不能用双缩脲试剂检验蛋白质是否被蛋白酶水解,除了因为蛋白质的水解产物也可以与双缩脲试剂有显色反应,还因为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,根据表中的①~⑩中元素,用相关的化学用语填空:
IA | 0 | |||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | ⅦA | |
2 | ⑩ | ② | ③ | ④ | ⑧ | |||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素⑩的名称是 , 从元素原子得失电子的角度看,元素④具有(填“氧化性”、“还原性”);比元素⑧质子数多16的元素在周期表中所处位置;
(2)⑥④⑦的氢化物稳定性由弱到强的顺序依次:(写氢化物的化学式);
(3)元素③的气态氢化物与其最高价氧化物的水化物反应的方程式为;
(4)写出元素⑤形成的单质在氧气中燃烧产物的电子式 , 这一反应是(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为;
(5)用电子式表示①与⑨反应得到的化合物的形成过程;
(6)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.HXR的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 氢氧化铝可以用于治胃酸过多
B. Fe3O4可用作红色油漆和涂料
C. 金属钠有强还原性,能和硫酸铜溶液反应,但不能置换出金属铜
D. 为使面包松软可口可用碳酸氢钠做发泡剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是 ( )

A. 该温度下,Ksp(MnS)大于1.0×10-35
B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出
D. 该温度下,溶解度:CuS>MnS>FeS>ZnS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定H2C2O4溶液,当_______时,滴定结束。
④记录数据,重复实验。整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)步骤①需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(2)该反应原理的离子方程式为___________________________________;
(3)请将步骤③补充完整_________________________________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(5)若滴定终点读数时俯视液面,则x值会________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com