
ЁОЬтФПЁПЖЬжмЦкдЊЫиAЁЂBЁЂCЁЂDЃЌAдЊЫиЕФдзгзюЭтВуЕчзгЪ§ЪЧФкВуЕчзгЪ§ЕФСНБЖЃЌBЮЊЕиПЧжаКЌСПзюЖрЕФдЊЫиЃЌCЪЧдзгАыОЖзюДѓЕФЖЬжмЦкжїзхдЊЫиЃЌCгыDаЮГЩЕФРызгЛЏКЯЮяCDЪЧГЃгУЕФЕїЮЖЦЗЁЃЬюаДЯТСаПеАзЃК
ЃЈ1ЃЉA B2ЕФНсЙЙЪН_______________ЃЛCдЊЫидкжмЦкБэжаЕФЮЛжУЕк_______жмЦк________зх
ЃЈ2ЃЉBЁЂCзщГЩЕФвЛжжЛЏКЯЮягыЫЎЗЂЩњЛЏКЯЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК____________________
ЃЈ3ЃЉШчЭМЫљЪОЃЌЕчНтжЪaШмвКЮЊКЌгаCDЕФБЅКЭШмвКЁЃXЮЊЪЏФЋЕчМЋЃЌYЮЊЬњЕчМЋЃЌНгЭЈжБСїЕчдДЁЃ
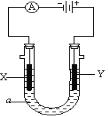
XЕчМЋЕФЕчМЋЗДгІЪНЮЊ________________________ЁЃ
YЕчМЋЕФЕчМЋЗДгІЪНЮЊ________________________ЁЃ
ЃЈ4ЃЉГЃЮТЯТЃЌЯрЭЌЬхЛ§ЕФ0.2molЁЄLЁЊ1CDШмвКгы0.1molЁЄLЁЊ1 C2AB3ШмвКжаЃЌзмРызгЪ§ФПНЯЖрЕФЪЧ______________ШмвКЃЈЬюЛЏбЇЪНЃЉЁЃ
ЁОД№АИЁПO=C=O 3 IA Na2O + H2O == 2NaOH 2H+ + 2eЃ = H2ЁќЃЈЛђ2H2O + 2eЃ = H2Ёќ+ 2OHЃЃЉ FeЁЊ2eЃ= Fe2+ NaCl
ЁОНтЮіЁП
ЖЬжмЦкдЊЫиAЁЂBЁЂCЁЂDЃЌAдЊЫиЕФдзгзюЭтВуЕчзгЪ§ЪЧФкВуЕчзгЪ§ЕФСНБЖЃЌAЮЊCдЊЫиЃЌBЮЊЕиПЧжаКЌСПзюЖрЕФдЊЫиЃЌBЮЊOдЊЫиЃЌCЪЧдзгАыОЖзюДѓЕФЖЬжмЦкжїзхдЊЫиЃЌCЮЊФЦЃЌCгыDаЮГЩЕФРызгЛЏКЯЮяNaClЪЧГЃгУЕФЕїЮЖЦЗЁЃ
ЖЬжмЦкдЊЫиAЁЂBЁЂCЁЂDЗжБ№ЮЊЃКCЁЂOЁЂNaЁЂClЁЃ
ЃЈ1ЃЉЖўбѕЛЏЬМжаЕФЬМзюЭтВу4ИіЕчзгЃЌЗжБ№гыOаЮГЩСНИіЙВМлМќЃЌAB2ЕФНсЙЙЪНO=C=OЃЌCдЊЫиЮЊФЦдЊЫиЃЌдкжмЦкБэжаЮЛгкЕк3жмЦкIAзхЃЛ
ЃЈ2ЃЉBЁЂCзщГЩЕФвЛжжЛЏКЯЮяЪЧбѕЛЏФЦЃЌгыЫЎЗЂЩњЛЏКЯЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКNa2O + H2O == 2NaOHЃЛ
ЃЈ3ЃЉЕчНтNaClЕФБЅКЭШмвКЃЌXЮЊЪЏФЋЕчМЋЃЌгыЕчдДИКМЋЯрСЌЃЌзївѕМЋЃЌXЕчМЋЕФЕчМЋЗДгІЪНЮЊ 2H+ + 2eЃ = H2ЁќЃЈЛђ2H2O + 2eЃ = H2Ёќ+ 2OHЃЃЉЁЃYЮЊЬњЕчМЋЃЌгыжБСїЕчдДе§МЋЯрСЌЃЌЗЂЩњбѕЛЏЗДгІЁЃYЕчМЋЕФЕчМЋЗДгІЪНЮЊFeЁЊ2eЃ= Fe2+ЁЃ
ЃЈ4ЃЉГЃЮТЯТЃЌЯрЭЌЬхЛ§ЕФ0.2molЁЄLЁЊ1NaClШмвКгы0.1molЁЄLЁЊ1Na2CO3ШмвКжаЃЌФЦРызгЪ§ЯрЭЌЃЌЬМЫсИљВПЗжЫЎНтЃЌвѕРызгзмЪ§ЩйгкФЦРызгЃЌзмРызгЪ§ФПНЯЖрЕФЪЧNaClШмвКЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЪЧЪЕбщЪвНјааЖўбѕЛЏСђжЦБИгыаджЪЪЕбщЕФзщКЯзАжУЃЌВПЗжЙЬЖЈзАжУЮДЛГіЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ

A. ЮЊЗРжЙЛЗОГЮлШОЃЌзАжУCКЭEжаЕФЪдМСОљШЁгУБЅКЭЕФЪЏЛвЫЎ
B. ЙиБе K2ЃЌДђПЊ K1ЃЌЕЮМгСђЫсЃЌдђзАжУ B жаУПЯћКФ1mol Na2O2ЃЌзЊвЦ1molЕчзг
C. ЙиБе K1ЃЌДђПЊ K2ЃЌЪдМС X ЪЧЫсад KMnO4 Лђ FeCl3 ШмвКЃЌОљПЩжЄУї SO2 гаЛЙдад
D. ЪЕбщЙ§ГЬжаЬхЯжСЫСђЫсЕФЫсадЁЂЮќЫЎадЁЂФбЛгЗЂадЁЂЧПбѕЛЏад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгаМИЦПЯдЫсадЕФШмвКЃЌ4ЮЛЭЌбЇбЁдёСЫЦфжаЫФЦПВтЖЈЦфжаЫљКЌЕФНЯДѓХЈЖШЕФРызгЃЌЫћУЧЕФНсТлвЛЖЈДэЮѓЕФЪЧЃЈ ЃЉ
A.Fe3+ЁЂAl3+ЁЂCl-ЁЂBr-B.Fe2+ЁЂCu2+ЁЂSO42-ЁЂNO3-
C.Na+ЁЂK+ЁЂNO3-ЁЂCl-D.Mg2+ЁЂCu2+ЁЂCl-ЁЂNO3-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђМзЁЂввЁЂБћШ§ИіУмБеШнЦїжаГфШывЛЖЈСПЕФAКЭBЃЌЗЂЩњЗДгІЃКA(g)+xB(g) ![]() 2C (g)ЃЌИїШнЦїЕФЗДгІЮТЖШЁЂЗДгІЮяЦ№ЪМСПЃЌЗДгІЙ§ГЬжаCЕФХЈЖШЫцЪБМфБфЛЏЙиЯЕЗжБ№вдЯТБэКЭШчЭМБэЪОЃК
2C (g)ЃЌИїШнЦїЕФЗДгІЮТЖШЁЂЗДгІЮяЦ№ЪМСПЃЌЗДгІЙ§ГЬжаCЕФХЈЖШЫцЪБМфБфЛЏЙиЯЕЗжБ№вдЯТБэКЭШчЭМБэЪОЃК
ШнЦї | Мз | вв | Бћ |
ШнЛ§ | 0.5L | 0.5L | 1.0L |
ЮТЖШ/Ёц | T1 | T2 | T2 |
ЗДгІЮя Ц№ЪМСП | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |

ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. 10minФкМзШнЦїжаЗДгІЕФЦНОљЫйТЪv(A)=0.025mol/(Lmin)
B. гЩЭМПЩжЊЃКT1ЃМT2ЃЌЧвИУЗДгІЮЊЮќШШЗДгІ
C. x=1ЃЌШєЦНКтЪББЃГжЮТЖШВЛБфЃЌИФБфШнЦїЬхЛ§ЦНКтвЦЖЏ
D. T1ЁцЃЌЦ№ЪМЪБМзШнЦїжаГфШы0.5molAЁЂ1.5molBЃЌЦНКтЪБAЕФзЊЛЏТЪЮЊ75%
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕШжЪСПЕФСНЗнаПЗлaКЭbЃЌЗжБ№МгШыЙ§СПЕФЯЁСђЫсжаЃЌaжаЭЌЪБМгШыЩйСПCuSO4ШмвКЃЌЯТСаЭМжаБэЪОЦфВњЩњH2ЕФзмЬхЛ§(V)гыЪБМф(t)ЕФЙиЯЕе§ШЗЕФЪЧЃЈ ЃЉ
A. 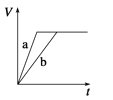 B.
B. 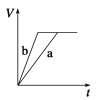
C. 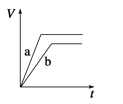 D.
D. 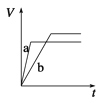
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮяжЪЕФСПЯрЭЌЕФH2OКЭNH3вЛЖЈОпгаЯрЭЌЕФЃЈ ЃЉ
A.дзгИіЪ§B.жЪСПC.ЬхЛ§D.ЗжзгИіЪ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПыТ(N2H4)ЪЧЛ№М§ЗЂЖЏЛњЕФвЛжжШМСЯЃЌЗДгІЪБN2O4ЮЊбѕЛЏМСЃЌЩњГЩN2КЭЫЎеєЦјЁЃвбжЊЃКN2(g)+2O2(g)====N2O4(g) ІЄH="+8.7" kJЁЄmol-1
N2H4(g)+O2(g) ====N2(g)+2H2O(g) ІЄH="-534.0" kJЁЄmol-1
ЯТСаБэЪОыТИњN2O4ЗДгІЕФШШЛЏбЇЗНГЬЪНЃЌе§ШЗЕФЪЧЃЈ ЃЉ
A. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ІЄH="-542.7" kJЁЄmol-1
B. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ІЄH="-1" 059.3 kJЁЄmol-1
C. N2H4(g)+1/2 N2O4(g) ====3/2N2(g)+2H2O(g)ІЄH="-1" 076.7 kJЁЄmol-1
D. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ІЄH="-1" 076.7kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПa mol O2ЦјЬхКЭa mol O3ЦјЬхЯрБШНЯЃЌЯТСаа№ЪівЛЖЈе§ШЗЕФЪЧ
A. ЬхЛ§ЯрЕШ B. ЗжзгЪ§ЯрЕШ C. дзгЪ§ЯрЕШ D. жЪСПЯрЕШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкФГЮТЖШЯТЃЌЗДгІClF(g)+F2(g) ![]() ClF3(g)ЃЈе§ЗДгІЮЊЗХШШЗДгІЃЉдкУмБеШнЦїжаДяЕНЦНКтЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
ClF3(g)ЃЈе§ЗДгІЮЊЗХШШЗДгІЃЉдкУмБеШнЦїжаДяЕНЦНКтЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ЮТЖШВЛБфЃЌЫѕаЁЬхЛ§ЃЌClFЕФзЊЛЏТЪдіДѓ
B. ЮТЖШВЛБфЃЌдіДѓЬхЛ§ЃЌClF3ЕФВњТЪЬсИп
C. Щ§ИпЮТЖШЃЌдіДѓЬхЛ§ЃЌгаРћгкЦНКтЯђе§ЗДгІЗНЯђвЦЖЏ
D. НЕЕЭЮТЖШЃЌЬхЛ§ВЛБфЃЌF2ЕФзЊЛЏТЪНЕЕЭ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com