
 →
→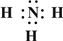 ,B的结构式为
,B的结构式为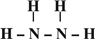 .
.分析 X、Y、Z、L、M五种元素的原子序数依次增大,Z、L是空气中含量最多的二种元素,则Z为N元素,L为O元素;M是地壳中含量最高的金属元素,则M为Al元素;Y原子的最外层电子数是次外层电子数的两倍,Y由2个电子层,最外层电子数为4,故Y为C元素;X的阴离子与Y的内层电子数相等,X的阴离子有2个电子,故X为H元素,据此进行解答.
解答 解:X、Y、Z、L、M五种元素的原子序数依次增大,Z、L是空气中含量最多的二种元素,则Z为N元素,L为O元素;M是地壳中含量最高的金属元素,则M为Al元素;Y原子的最外层电子数是次外层电子数的两倍,Y由2个电子层,最外层电子数为4,故Y为C元素;X的阴离子与Y的内层电子数相等,X的阴离子有2个电子,故X为H元素,
(1)由上述分析可知,L为氧元素;同周期随原子序数增大,原子半径减小,电子层越大原子半径越大,所以五种元素的原子半径从小到大的顺序是H<O<N<C<Al,
故答案为:氧元素;H<O<N<C<Al;
(2)Z为N元素、X为H元素,Z、X两元素按原子数目比1:3和2:4构成分子A为NH3,B为N2H4,用电子式表示NH3的形成过程为3H•+ →
→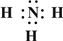 ,N2H4的结构式为
,N2H4的结构式为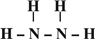 ,
,
故答案为:3H•+ →
→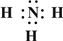 ;
;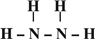 ;
;
(3)硒(Se)与O元素同一主族,最外层电子数为6,Se原子比L原子多两个电子层,有4个电子层,各层电子数为2、8、18、6,则Se的原子序数为2+8+18+6=34,最高化合价为+6价,最高价氧化物对应的水化物化学式为:H2SeO4;
故答案为:34;H2SeO4;
(4)一定条件下,Al与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分,乙为Al2O3,该反应生成lmolAl2O3时放出536kJ热量,其热化学方程式为 4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)△H=-1072g/mol,
故答案为:4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)△H=-1072g/mol.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,涉及元素化合物推断、常见10电子、18电子微粒及性质,元素周期律,常用化学用语等知识,推断元素与物质是关键,学生要熟练掌握10电子、18电子微粒及微粒之间的反应,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g C-13含有的原子数为NA个 | |
| B. | 46g NO2和46g N2O4含有的原子数均为3NA | |
| C. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| D. | 标准状况下,2.24L乙醇所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物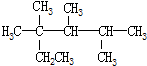 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| B. | 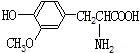 与 与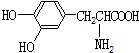 都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 | |
| C. | 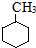 的一溴代物和 的一溴代物和 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=1的溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com