
【题目】下列物质中互为同系物的有 ;互为同分异构体的有 ;互为同素异形体的有 ;属于同位素的有 ;是同一种物质的有
①O2 ②氯仿 ③CH3CH2OH ④O3 ⑤CHCl3 ⑥CH3﹣O﹣CH3
⑦![]() C ⑧
C ⑧![]() ⑨
⑨![]() C ⑩CH3OH.
C ⑩CH3OH.
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. l04g苯乙烯(C6H5-CH=CH2)中含有8NA的碳氢键和4NA的碳碳双键
B. 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA
C. lmol有机物CH3-CH=CH-CH2-CH3中最多有9NA个原子在同一平面上
D. 80℃ 时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 0.5molO3与11.2LO2所含的分子数一定相等
C. 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-数为NA
D. 1molFe与足量稀盐酸反应时,转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PM2.5指大气中直径小于或等于2.5微米(1微米等于10-6m ) 的颗粒物,对空气质量和能见度有重要影响。若将直径为2.5微米颗粒物分散到水中,形成的分散系属于( )
A. 溶液 B. 胶体 C. 浊液 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 为比较Cl2、Fe3+、SO2的氧化性,用下图所示装置进行实验,其过程如下:

①.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
②.打开活塞a,滴加一定量的浓盐酸,给A加热。
③.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2。
④.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
⑤.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
⑥.更新试管D,重复过程④,检验B溶液中的离子。
(1)棉花中浸润的溶液为__________。
(2)当A中足量固体加入36.5%密度为1.2g/mL盐酸100mL时,其反应转移的电子数目为______。
(3)过程⑥中检验B溶液中是否含有硫酸根离子的操作是___________。
(4)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性的是____同学,其氧化性顺序为____________。
过程④ B溶液中含有的离子 | 过程⑥ B溶液 中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
II. NaNO2是重要的防腐剂,+3价的氮易发生氧化反应且在酸性环境中不稳定。其5mol/L水溶液pH为9。某化学兴趣小组设计如下图所示装置制备亚硝酸钠。其操作是①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;②一段时间后停止加热。回答下列问题:

(1)B中观察的主要现象是__________,D装置的作用是____________。
(2)检验C中产物有亚硝酸钠的操作是_______,相应反应方程式为___________。
(3)经检验C中产物亚硝酸钠含量较少。a. 甲同学认为C中产物不仅有亚硝酸钠,还有其他杂质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂是_______(写名称)。b. 乙同学认为除上述干扰因素外,还会有氧气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是___。
(4)由题给条件计算HNO2的Ka数值为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的叙述不正确的是
A.淀粉水解可以制得葡萄糖
B.碘酒可使细菌、病毒的蛋白质变性而死亡
C.氨基酸是两性化合物,能与酸或碱反应生成盐
D. 光导纤维遇盐酸和氢氧化钠溶液都不会被损坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
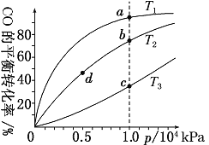
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(a)<M(c) M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理含氮的化合物,在生产生活中有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
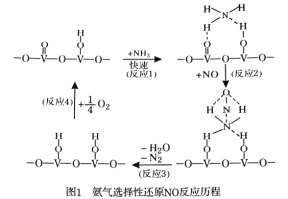
写出总反应化学方程式 。
(2)已知N2(g)+3H2(g)![]() 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。

①在2L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 。
②25min时采取的措施是 。
③时段III条件下,反应的平衡常数表达式为 (只列计算表达式,不计算)。
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
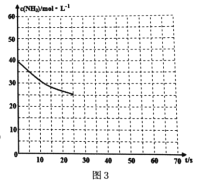
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,指纹就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是( )
A.①AgNO3 ②NaBr ③AgBr
B.①AgNO3 ②NaCl ③AgCl
C.①AgCl ②AgNO3 ③NaCl
D.①AgNO3 ②NaI ③AgI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com