
【题目】合理应用和处理含氮的化合物,在生产生活中有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
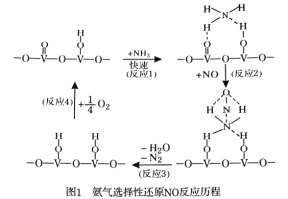
写出总反应化学方程式 。
(2)已知N2(g)+3H2(g)![]() 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。

①在2L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 。
②25min时采取的措施是 。
③时段III条件下,反应的平衡常数表达式为 (只列计算表达式,不计算)。
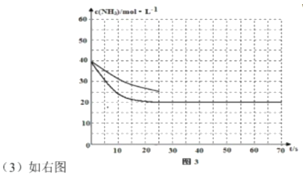
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
【答案】(1)4NH3+4NO+O2=4N2+6H2O
(2)①0.050molL-1min-1 (2分,无单位扣1分) 94.4kJ (2分)![]()
② 将NH3从反应体系中分离出去(2分)
![]()
【解析】(1)由图示可判断氨气将NO还原成N2时还有O2参加,且NH3和O2的物质的量之比为4:1因此总反应化学方程式为;4NH3+4NO+O2=4N2+6H2O。
(2)①在2L容器中发生反应,前20min内,v(NH3)=1/20=0.050molL-1min-1,消耗了2molNH3,放出的热量为94.4KJ。
②25min时H2、N2继续减少,NH3的量由0开始增加,采取的措施是将NH3从反应体系中分离出去。
③时段III条件下,各物质的物质的量为:c(H2)=0.75mol/L,c(N2)=0.25mol/L ,c(NH3)=0.50mol/L,平衡常数K=0.502/(0.25×0.753)。
(3)使用催化剂后加快了反应速率,到达平衡所需时间短,但不影响平衡,CO2的转化率仍为50%,由此可画出曲线:


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】实验室中需要0.2molL﹣1的CuSO4溶液950mL,配制时应选用的容量瓶的规格和称取胆矾晶体(CuSO45H2O式量为250)的质量分别是( )
A.1000mL 50.0g
B.950mL 47.5g
C.950mL 30.4g
D.1000mL 32.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中互为同系物的有 ;互为同分异构体的有 ;互为同素异形体的有 ;属于同位素的有 ;是同一种物质的有
①O2 ②氯仿 ③CH3CH2OH ④O3 ⑤CHCl3 ⑥CH3﹣O﹣CH3
⑦![]() C ⑧
C ⑧![]() ⑨
⑨![]() C ⑩CH3OH.
C ⑩CH3OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系正确的一组是
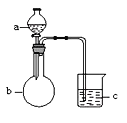
选项 | a | b | c | 现象 | 结论 |
A | 饱和食盐水 | 碳化钙 | 溴水 | c中溶液黄色褪去 | 乙炔发生还原反应 |
B | 浓盐酸 | KMnO4固体 | NaBr溶液 | c中溶液由无色变橙色 | Cl2的氧化性比Br2强 |
C | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | 碳酸的酸性比硅酸强 |
D | 硫酸 | Na2SO3固体 | 酸性KMnO4溶液 | c中溶液紫色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 发生化学反应时失去电子越多的金属原子,还原能力越强
B. NaCl只有在水溶液中才能电离出Na+、Cl-
C. 能与酸反应的氧化物,不一定是碱性氧化物
D. 电离时能产生H+的化合物是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述错误的是( )·
A.用热的的纯碱溶液清除灶具上的油污
B.用硫酸清洗锅炉中的水垢
C.用明矾[KAl(SO4)2 ·12H2O]作净水剂,除去水中悬浮的杂质
D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.3.2 g臭氧中含有的氧原子数为0.2NA
B.0.1 mol苯中含有的碳碳双键数目为0.3NA
C.1 L 0.1 mol/LCH3COOH溶液中含有的氢原子数为0.1NA
D.标准状况下,22.4 L盐酸中含有的HC1分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com