
【题目】化学与生产、生活密切相关,下列叙述错误的是( )·
A.用热的的纯碱溶液清除灶具上的油污
B.用硫酸清洗锅炉中的水垢
C.用明矾[KAl(SO4)2 ·12H2O]作净水剂,除去水中悬浮的杂质
D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
科目:高中化学 来源: 题型:
【题目】PM2.5指大气中直径小于或等于2.5微米(1微米等于10-6m ) 的颗粒物,对空气质量和能见度有重要影响。若将直径为2.5微米颗粒物分散到水中,形成的分散系属于( )
A. 溶液 B. 胶体 C. 浊液 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理含氮的化合物,在生产生活中有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
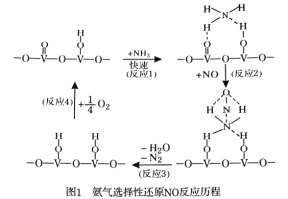
写出总反应化学方程式 。
(2)已知N2(g)+3H2(g)![]() 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。

①在2L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 。
②25min时采取的措施是 。
③时段III条件下,反应的平衡常数表达式为 (只列计算表达式,不计算)。
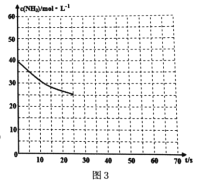
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与热能、电能等能相互转化.则化学能与其他能量相互转化说法正确的是( )
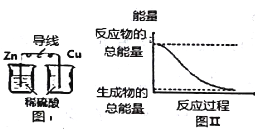
A. 中和反应中,反应物的总能量比生成物的总能量低
B. 化学反应中能量变化的主要原因是化学键的断裂与生成
C. 图I所示的装置能将化学能转变为电能
D. 图Ⅱ所示的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题。

(1)制作腐乳的主要原料是黄豆,黄豆富含人体所需的营养物质主要是_______。制作腐乳用到了加碘盐,即在食盐中加入_______(写出碘化合物的名称或化学式)。
(2)腐乳在酿制过程中会产生多种氨基酸,故味道鲜美,这些氨基酸的通式为________。腐乳虽好但不能作为主食,原因在于腐乳所含的_______类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质。
(3)盛装腐乳的陶罐属于_______(填“无机”或“有机”)非金属材料制品,陶罐的主要成分为_______酸盐。
(4)外包装纸盒所用纸的主要成分是____________。包装盒提绳的主要成分是聚丙烯塑料,由丙烯合成聚丙烯的化学方程式为:_____________________________。
(5)聚丙烯等材料制成的塑料制品不应随意丢弃,以免造成俗称“_________污染”的环境问题。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,指纹就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是( )
A.①AgNO3 ②NaBr ③AgBr
B.①AgNO3 ②NaCl ③AgCl
C.①AgCl ②AgNO3 ③NaCl
D.①AgNO3 ②NaI ③AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
II.Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O
[猜想假设] 黑色粉末X的组成可能是_________、_________,或二者的混合物。
[实验探究]
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色。 |
② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
(1)实验①中产生气泡的离子方程式为_________。
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:_________。
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如下图所示实验:
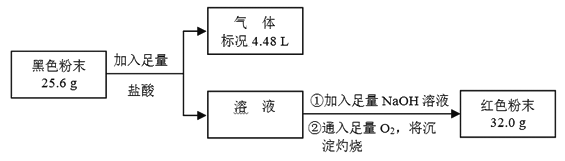
请根据数据分析说明黑色粉末X中是否含有Fe3O4。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。

(1)仪器A的名称是________________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜__________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_____________,

理由:_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com