
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
【答案】
(1)污染小;可再生;来源广;资源丰富;燃烧热值高(任写其中2个);H2+2OH--2e-=2H2O
(2)<
(3)ac
(4)光能转化为化学能
(5)①阳极室
②防止Na2FeO4与H2反应使产率降低
③M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低)。
【解析】
试题分析:(1)与汽油相比,氢气作为燃料的优点有污染小;可再生;来源广;资源丰富;燃烧热值高等,碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O,故答案为:污染小;可再生;来源广;资源丰富;燃烧热值高;H2+2OH--2e-=2H2O
(2)①H2(g)+A(l)=B(l) ΔH1,②O2(g)+B(l)=A(l)+H2O2(l) ΔH2,两反应的ΔS<0,根据ΔG=ΔHTΔS,因为均为两反应自发反应,因此ΔH均小于0,将①+②得:H2(g)+ O2(g)= H2O2(l)的ΔH=ΔH1+ΔH1<0,故答案为:<;
(3)MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。a.平衡时气体的物质的量不变,压强不变,正确;b.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;c.降低温度,平衡向正反应方向移动,平衡常数增大,正确;d.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误;故选ac;
MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。a.平衡时气体的物质的量不变,压强不变,正确;b.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;c.降低温度,平衡向正反应方向移动,平衡常数增大,正确;d.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误;故选ac;
(4)利用太阳能直接分解水制氢,是将光能转化为化学能,故答案为:光能转化为化学能;
(5)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH)降低的区域在阳极室,故答案为:阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,故答案为:防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,故答案为:M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低)。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】《化学与生活》
(1)合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①蛋白质是人体必需的营养物质,它在人体内最终分解为( )。
A.葡萄糖 B.氨基酸 C.脂肪酸
②现有下列五种物质 A食盐 B食醋 C苹果汁 D葡萄糖 E青霉素,请按下列要求填空(填序号)。
富含维生素C的是 ;可直接进入血液,补充能量的是 ;应用最广泛的抗生素之一的是 ;即可作为调味剂,又可作为防腐剂的是 ;食用过多会引起血压升高、肾脏受损的 。
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是( )。
A.酒精 B.蔗糖 C.甲醛
②一般情况下,合金比组成它的成分金属硬度 (填大、小)。
③常用来作半导体的物质是 (填化学式);用作食品保鲜膜的的高分子材料的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.0l mol·L-l s溶液的pH为12,q、s的焰色反应均呈黄色。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径:W<X<Y<Z
B. 通常状况下,X的氢化物可能呈气态、液态或固态
C. Y的氢化物的沸点比Z的氢化物的沸点高
D. 由W、X、Y、Z四种元素只能组成一种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述错误的是( )·
A.用热的的纯碱溶液清除灶具上的油污
B.用硫酸清洗锅炉中的水垢
C.用明矾[KAl(SO4)2 ·12H2O]作净水剂,除去水中悬浮的杂质
D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
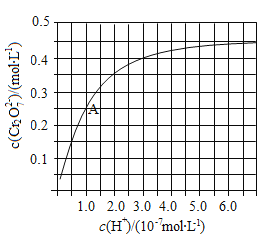
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X(g)+2Y(g)![]() 2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关垃圾处理的方法不正确的是:
A. 垃圾处理常用的方法是卫生填埋、焚烧、堆肥
B. 将垃圾分类回收是垃圾处理的发展方向
C. 填埋垃圾不需处理,只深埋即可
D. 焚烧垃圾产生大量污染空气的物质,故不易采用此方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com