
物质的量浓度相同的下列物质中,含粒子种类最多的是
A.CaCl2 B.CH3COONa C.K2S D.NH3
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
取100mL Fe(NO3)3与Cu(NO3)2的混合液,若这两种溶液物质的量浓度相等。在混合液中加入2.5mol/L NaOH溶液150mL恰好反应,则原溶液中NO3-的浓度为
A.1.25mol/L B.3.75mol/L C.2.5mol/LD.5.0mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省豫东、豫北十所名校高三阶段性测试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业。请回答下列问题。
(1)列举两种海水淡化的方法:_________、_________。
(2)氯碱工业通过电解饱和食盐水能获得烧碱和氯气等物质,该反应的化学方程式为_____________,如图是用离子交换膜法电解饱和食盐水的原理示意图。其中石墨接电源_________极,电解时铁电极的电极反应式为_________。电解过程中通过离子交换膜的主要离子是__________。

(3)侯氏制碱法中,首先向饱和食盐水中通入CO2和NH3制备NaHCO3,其化学方程式为____________;先通入的是__________(填化学式),其理由是__________________ ;再利用NaHCO3受热分解可制备纯碱。
(4)目前世界上60%以上的镁都是从海水中提取的,已知:MgO和MgCl2的熔点分别为2852℃和714℃。分析说明工业上采用电解熔融MgCl2而不是电解熔融MgO的理由__________ ______________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
下列有关除杂质(括号中为杂质)的操作中,错误的是
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.乙醇(水):加入足量生石灰,蒸馏,收集馏出物
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
近年来流行喝苹果醋。苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品。苹果酸( 一羟基丁二酸)是这种饮料的主要酸性物质,其结构如下图所示:
一羟基丁二酸)是这种饮料的主要酸性物质,其结构如下图所示:

下列相关说法正确的是
A.苹果酸在一定条件下能发生消去反应
B.苹果酸在一定条件下能催化氧化生成醛
C.苹果酸在一定条件下能发生加聚反应生成高分子化合物
D.l mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
下列关于反应热的说法正确的是
A.当△H为“一”时,表示该反应为吸热反应
B.已知C(s)+ O2(g)
O2(g) CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
C.反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小
D.反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高三第二次模拟考试理综化学试卷(解析版) 题型:推断题
(14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:
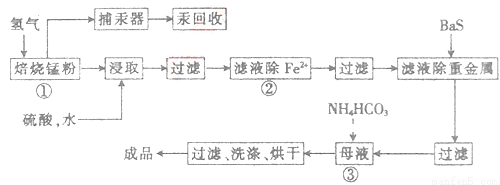
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:

写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+

(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:选择题
下列说法正确的是
A.天然气和沼气的主要成分是乙烯,它们都属于不可再生能源
B.煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料
C.石油分馏得到的汽油、煤油、柴油等都是混合物,但有固定的熔沸点
D.石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:填空题
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:

①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
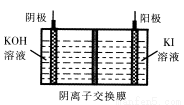
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com