
����Ŀ���ҹ���ѧ�������������о�����ȡ����һϵ�е��ش�ͻ�ƣ���־���ҹ�������̬���������Ѿ���Ϊһ��ǿ����LiZnAs ���о������������ϵ���Ҫǰ�塣
(1)LiZnAs ������Ԫ�صĵ縺�Դ�С�����˳��Ϊ_____��
(2)AsF3 ���ӵĿռ乹��Ϊ_____��As ԭ�ӵ��ӻ��������Ϊ_____��
(3)CO ����������λ���Ĵ��ڣ�ʹ C ԭ���ϵĵ������ܶȽϸ߶�����Ѫ�쵰��ϣ� ���� CO �о綾��1mol[Zn(CN)4]2-�����ں��еĹ��ۼ�����ĿΪ_____����ԭ��Ϊ_____��
(4)���������ﳣ�����缫���ϵĻ��ʡ������ NiO ����Ľṹ�� NaCl �ľ���ṹ��ͬ��Ϊ��ø��õĵ���������������� NiO �����ڿ����м��ȣ�ʹ���� Ni2+�������� Ni3+�� ÿ�������� O2-����Ŀ��λ�þ�δ�����仯�������ӵ�λ����Ȼû�䣬������Ŀ���٣���ɾ����ڲ��������ӿ�λ����ͼ��ʾ������ѧʽΪ NiO ��ij�������ᄃ�壬�����ӵ�ƽ����λ��Ϊ__________�������ӵ�ƽ����λ���봿��� NiO �������____________����������������С����������������д����������Ԫ�ػ��ϼ۵ĸþ���Ļ�ѧʽ________ʾ����Fe3O4 д�� Fe2+Fe23+O4����

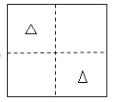
(5)���еľ�����ɿ�����ijЩ����һ���ķ�ʽ�ѻ��������ijЩ������������� �����γɵĿ�϶�С��������������ܶѻ��ľ����д����������͵Ŀ�϶���������϶���������϶��������ͼ��ʾ������ LiZnAs ���������У�Zn ������������ʽ�ѻ���Li �� As �ֱ������ Zn ԭ��Χ�ɵİ������϶���������϶�У��� a=0��0.5 �� 1 ���������� Zn �� Li ����ͼ��ʾ�ֲ���������ͼ As ԭ�����ڵĽ������������������� As ԭ�ӵ�λ�ã�______________��˵�� a=__________��


���𰸡�Li��Zn��As ���� sp3 16NA C 6 ��С Ni2+3Ni3+4O9 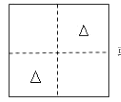 ��
�� 0.25�� �� 0.75��
0.25�� �� 0.75��
��������
��1����ǻ��ý�����п�ǽϻ��õĽ��������Ƿǽ�����ʧ���������������õ���������ǿ���縺����ǿ��LiZnAs ������Ԫ�صĵ縺�Դ�С�����˳��ΪLi��Zn��As��
�ʴ�Ϊ��Li��Zn��As
��2��AsF3 ���ӣ��۲���Ӷ�=3+![]() =4����һ�Թµ��Ӷԣ��ռ乹��Ϊ������As ԭ�ӵ��ӻ��������Ϊsp3��
=4����һ�Թµ��Ӷԣ��ռ乹��Ϊ������As ԭ�ӵ��ӻ��������Ϊsp3��
�ʴ�Ϊ��������sp3��
��3��CO ����������λ���Ĵ��ڣ�ʹ C ԭ���ϵĵ������ܶȽϸ߶�����Ѫ�쵰��ϣ� ���� CO �о綾��1mol[Zn(CN)4]2-�����ڹ��ۼ���C��N֮����������Zn��C֮������λ�������еĹ��ۼ�����ĿΪ��3��4+4��NA= 16NA�� C ԭ���ϵĵ������ܶȽϸߣ���ԭ��ΪC��
�ʴ�Ϊ�� 16NA��C��
��4������� NiO ����Ľṹ�� NaCl �ľ���ṹ��ͬ�������ӵ����¡�ǰ��������6�������ӣ������ӵ�ƽ����λ��Ϊ6������ Ni2+�������� Ni3+�������Ӽ��٣������ӵ�ƽ����λ���봿��� NiO ������ȼ�С��
���ݻ��ϼ۴����͵���0����Ͼ����ṹ����������Ԫ�ػ��ϼ۵ĸþ���Ļ�ѧʽNi2+3Ni3+4O9����
�ʴ�Ϊ��6����С��Ni2+3Ni3+4O9��
��5������� a=0��0.5 �� 1 ���������� Zn �� Li ����ͼ��ʾ�ֲ���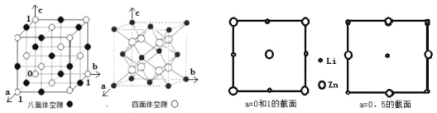 ���� LiZnAs ���������У�Zn ������������ʽ�ѻ���Li ����� Zn ԭ��Χ�ɵİ������϶���� As ����� Zn ԭ��Χ�ɵ��������϶�У� As ԭ�����ڵĽ��漴 a=0.25�� �� 0.75���Ľ����������������� As ԭ�ӵ�λ�ã���ͼ��
���� LiZnAs ���������У�Zn ������������ʽ�ѻ���Li ����� Zn ԭ��Χ�ɵİ������϶���� As ����� Zn ԭ��Χ�ɵ��������϶�У� As ԭ�����ڵĽ��漴 a=0.25�� �� 0.75���Ľ����������������� As ԭ�ӵ�λ�ã���ͼ��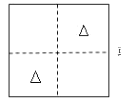 ��
��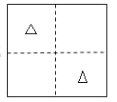 ��
��
�ʴ�Ϊ�� ��
�� ��0.25�� �� 0.75����
��0.25�� �� 0.75����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ԭ��ͬ�к͵ζ�ԭ�����ƣ�Ϊ�˲ⶨijδ֪Ũ�ȵ�NaHSO3��Һ��Ũ�ȣ�����0.2000mol/L������KMnO4��Һ���еζ����ش��������⣺
(1) ��ƽ���ӷ���ʽ��______MnO4-+HSO3-+H+=Mn2++SO42-+H2O��
(2)��KMnO4���еζ�ʱ��KMnO4��ҺӦװ��_______________�У��жϵζ��յ��������_______��
(3)���в����ᵼ�²ⶨ���ƫ�ߵ���_________��
A. ʢװδ֪ŨҺ����ƿ������ˮϴ����δ�ô���Һ��ϴ
B. δ�ñ�Ũ�ȵ�����KMnO4��Һ��ϴ�ζ���
C. �۲����ʱ���ζ�ǰ���ӣ��ζ�����
D. �ζ�ǰ�ζ��ܼ��첿�������ݣ��ζ���������ʧ
(4) �����±��ⶨ��ʵ�����ݣ�����KMnO4��Һ�����ƽ��ֵΪ___mL��NaHSO3��Һ�����ʵ���Ũ��Ϊ___mol/L�����ݾ�ȷ��0.1����
������ | ����NaHSO3��Һ�����/ mL | KMnO4��Һ���/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ʋ���������
A. ������84������Һ
������84������Һ
B.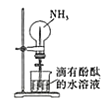 ������Ȫʵ��̽��NH3�IJ�������
������Ȫʵ��̽��NH3�IJ�������
C. �Ʊ�Fe(OH)2��ɫ����
�Ʊ�Fe(OH)2��ɫ����
D.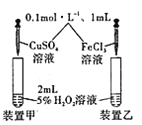 ̽����ͬ������˫��ˮ�ֽ����ʵ�Ӱ��
̽����ͬ������˫��ˮ�ֽ����ʵ�Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ�ͨ������;���Ʊ���

��ش��������⣺
��1�������ϩ�����������__��ԭ�ӹ�ƽ�档
��2�������ķ���ʽΪ__������ȴ�����_�֡�
��3����֪ϩ���ܷ������·�Ӧ��
 ��
��
��д�����з�Ӧ����Ľṹ��ʽ��![]()
![]() __��
__��
��4��A�Ƕ��ۻ����ϩ��ͬ���칹�壬��ʹ������Ȼ�̼��Һ��ɫ��A���������������Һ�����������Եõ��Ա���������ʾ�������ϵ����(��CH3����CH2R����CHR2)��ϩ���������������������Һ�������Ȼ���д��A���п��ܵĽṹ��ʽ�����������칹��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ˮ�е��ܽ��Ϊ��0.18g��4�棩��0.34g��25�棩��6.8g��95�棩��ij�����ᾧ�� �к���������������X������������Y������������װ�úͲ��������ᴿ��װ�ã�
�������ٳ��¹��ˢڳ��ȹ��ˢۼ����ܽ�ܽᾧ��ϴ�ӡ����������й�˵����ȷ����_________
A.�ü�װ���ܽ���Ʒ��X �ڵڢٲ�������
B.����װ�ó��ȹ��ˣ�Y �ڵڢڲ�������
C.�ñ�װ����ʾ�ķ����ᾧ
D.��ȷ�IJ���˳��Ϊ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к�����������-OCH2CH2O-�ظ���Ԫ���л���й��ѣ�18-��-6�Ľṹ��ʽ��ͼ��ʾ��

����˵����ȷ����( )
A.18-��-6�е���18��ָ���Ӻ���18��̼ԭ�ӣ���6��ָ���Ӻ���6����ԭ��
B.�÷���������ԭ�ӿ��ܹ�ƽ��
C.�÷��ӵ�һ�ȴ���ֻ��1��
D.���л�������ʽ�������ǵ���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̼��仯�������ִ���ҵ��ũҵ���������Ź㷺��Ӧ�ã�ͬʱҲ��ʵ�����г��õ���Ҫ�Լ���
(1)KMnO4��ǿ������������Һ��c(H+)=c(OH-)��������0.01molL-1��HMnO4��Һ��pH=_____________��
(2)MnS�����ڳ�ȥ��ˮ�е�Pb2+���ؽ�������:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq)���������������ˮ��c(Mn2+)=1 ��10-6 molL-1����c(Pb2+)=______________[��֪Ksp(PbS)=8��10-28��Ksp(MnS)=2��10-13]��
(3)����ũ������������Ҫ��Ԫ�أ�����������Һ���ֿ�ʹũ����������10%~15%��ij�������û��յķϾ�п�̸ɵ�����������̾���(MnSO4H2O)��������ͼ��ʾ��
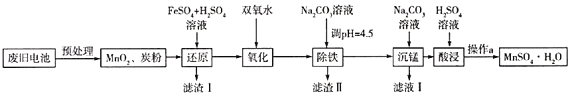
��MnSO4�к��еĻ�ѧ��������_______________��
�����������Ҫ�ɷ���____________����������һ�ֺ�ɫ���ʣ�����ԭ������������������Fe3+��д����Ӧ��Ӧ�����ӷ���ʽ_________���˷�Ӧ��MnO2��ת�������¶�֮��Ĺ�ϵ��ͼ��ʾ�������˵��¶���______________(����ĸ)��
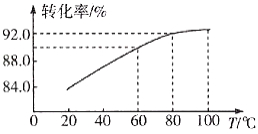
a.40 �� b.60 �� c.80 �� d.100 ��
����������������ɫ��ζ���������ɣ�����MnCO36Mn(OH)25H2O���ɣ�д����Ӧ��Ӧ�Ļ�ѧ����ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ʾ��ͼһ�µ���
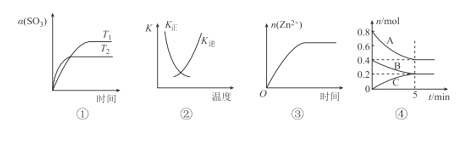
A.ͼ�ٱ�ʾ2SO3(g)=2SO2(g)+O2(g) ��H>0��SO3��ƽ��ת�������¶ȡ�ʱ��ı仯
B.ͼ�������߱�ʾ��ӦH2(g)+I2(g)=2HI(g) ��H<0�����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C.ͼ�۱�ʾ20 mL 0.1 mol/Lϡ���������п�����ʱ��n(Zn2+)��ʱ��ı仯
D.ͼ�ܷ�Ӧ�ӿ�ʼ��ƽ���ƽ����Ӧ����v(B)=0.04molL-1min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
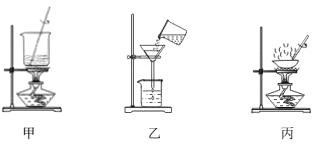
����Ŀ������ʵ��װ���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
|
|
|
|
A.�ⶨһ��ʱ�������� H2�ķ�Ӧ���� | B.���Խ����к��ȵIJⶨʵ�� | C.�Ƚ��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�� | D.�Ƚ�Cu2+��Fe3+�� H2O2�ֽ����ʵ�Ӱ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com